Frente a lo que algunas personas creen, en los ecosistemas marinos no solo existen “algas” s.a. como organismos vegetales fotosintetizadores, también encontramos plantas con flores, frutos y semillas (hidrófitos marinos o seagrasses). Son especies de angiospermas (fanerógamas) monocotiledóneas que pertenecen al "clado acuático" del orden Alismatales R.Br. ex Bercht. & J.Presl (APG IV, 2016). La diversidad taxonómica de estas plantas marinas es relativamente baja, pues están representadas a nivel global por unas 66 especies, dentro de unos 12-14 géneros (según autores) de 4 familias (den Hartog & Kuo, 2006). Efectivamente, estos taxones forman parte de cuatro familias botánicas, tres de ellas con especies exclusivamente marinas, Posidoniaceae Vines, Cymodoceaceae Vines y Zosteraceae Dumort., y la familia Hydrocharitaceae Juss., que engloba principalmente a especies de agua dulce y tres géneros marinos. Otros taxones, tolerantes a ambientes salinos, son discutidos como angiospermas de vida marina, como son la cosmopolita Ruppia marina (Ruppiaceae Horaninov) y la especie australiana Lepilaena marina (Zannichelliaceae Dumortier) (den Hartog & Kuo, 2006). Por tanto, no constituyen un grupo taxonómico sino como un grupo funcional o ecológico de especies con orígenes distintos (Waycott & al, 2006).
Biogeográficamente las angiospermas marinas están especialmente diversificadas en biorregiones tropicales (especialmente la Indo-Pacífica, con 14 especies), mientras que las biorregiones templadas del Atlántico norte presentan una baja riqueza de angiospermas marinas (1-2 especies).
La biorregión Mediterránea se encuentra entre estos dos extremos con una riqueza de especies media, con 5 especies marinas presentes (Figuras 1), Posidonia oceanica, Cymodocea nodosa, Zostera marina, Z. noltii y Halophila stipulacea (especie exótica invasora), y con Ruppia maritima y R. cirrhosa en lagunas litorales salobres (Short & al, 2007).
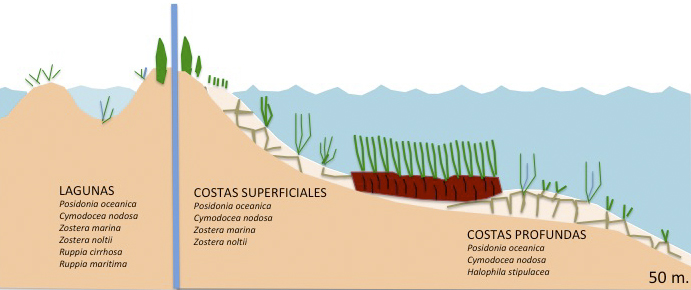
Las plantas angiospermas marinas, de las que existe un escaso registro fósil, se originaron evolutivamente a partir de plantas terrestres, que se adaptaron gradualmente al medio marino (Figura 2). Al formar parte de cuatro familias botánicas distintas, existe la hipótesis de que la transición desde el medio terrestre al marino puede haber ocurrido en diferentes períodos geológicos según los grupos taxonómicos. Efectivamente, los hidrófitos marinos son polifiléticos, presentan un origen independiente en tres linajes diferentes de las monocotiledóneas Alismatales (Les & al, 1997). Por otro lado, en este grupo ha habido poca especiación, ya que el número total de especies se ha mantenido relativamente bajo a lo largo del tiempo; las explicaciones más plausibles a este hecho apuntan a que las bajas tasas de reproducción sexual, pues se multiplican de activamente de forma vegetativa (clónica), junto con una dispersión limitada asociada a la polinización hidrófila, han restringido el flujo genético reduciendo la diversidad genética de estos taxones y su posibilidad de especiación (Akerman, 2006; Pérez & al, 2015).
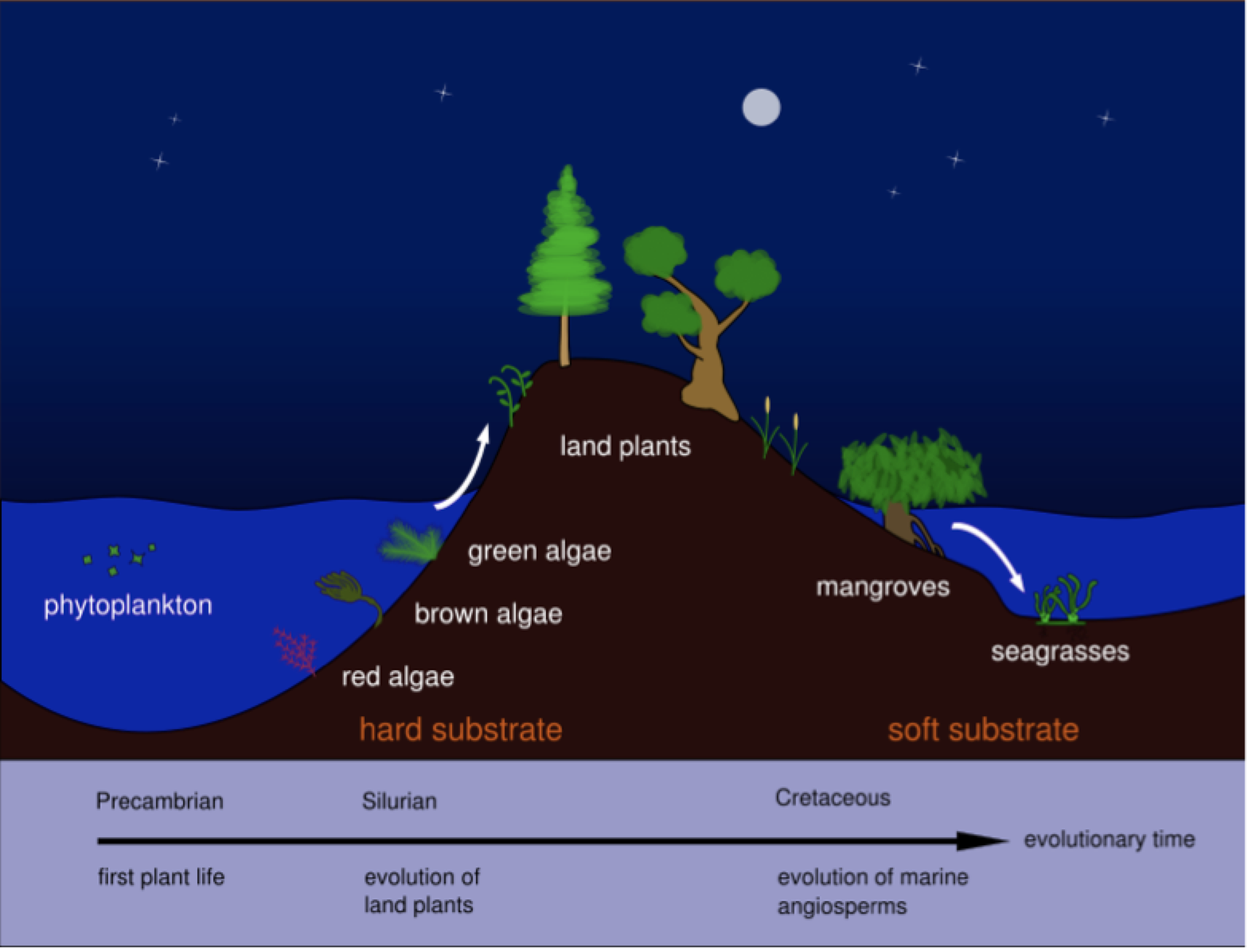
Los múltiples orígenes de las plantas marinas ofrecen un patente ejemplo de evolución convergente en las angiospermas, pues desarrollan diversas adaptaciones homólogas de tipo fisiológico y morfológico, tanto vegetativas como reproductivas, y completan su ciclo biológico en el mar. Por tanto, son morfológicamente muy similares, con pocos caracteres diagnósticos para diferenciar entre taxones debido a los relativamente simples caracteres morfológicos y anatómicos (existe homoplasia). Efectivamente, las angiospermas marinas mantienen una arquitectura básica y morfología similares a las de muchas plantas herbáceas monocotiledóneas terrestres conocidas (como muchas gramíneas) aunque con algunas salvedades (Figura 3) (Pérez & al, 2015).
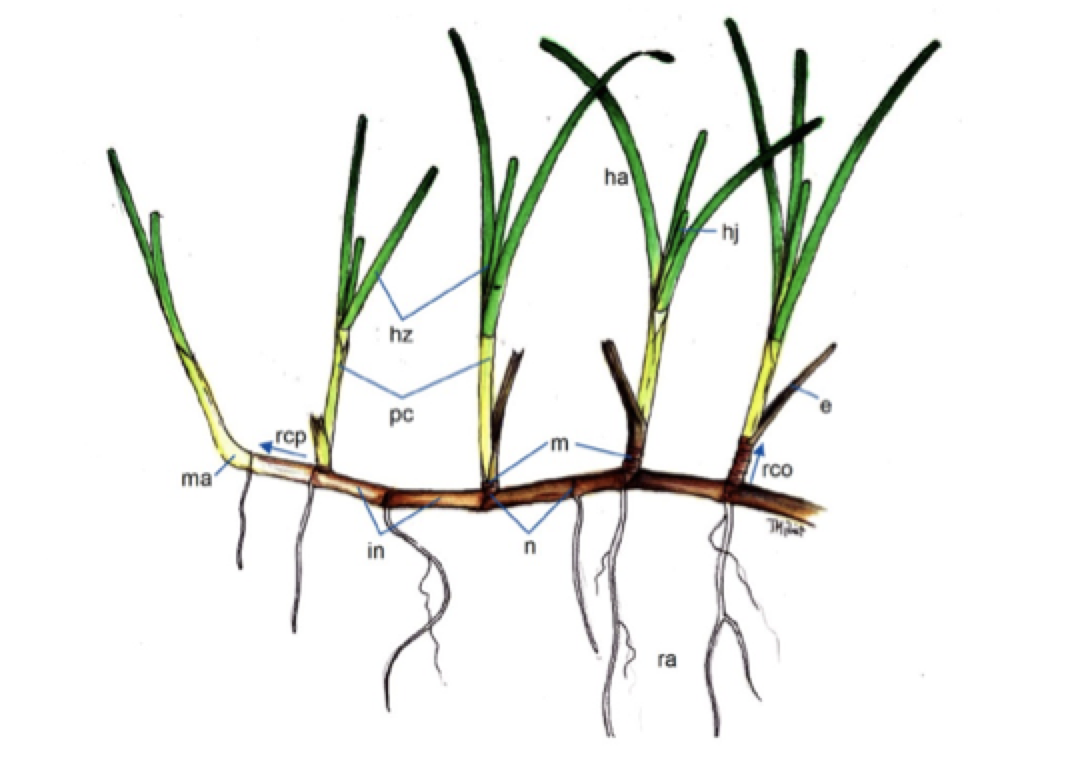
Se reproducen principalmente de forma clonal, por crecimiento vegetativo apical de los rizomas, que pueden fragmentarse (ramets). De los nudos de los rizomas surgen hojas en haces, que son largas y estrechas (acintadas, excepto en Halophila spp que son ovaladas), y raíces poco desarrolladas (hacia el sustrato). La reproducción sexual es poco frecuente, con flores (unisexuales o hermafroditas) solitarias o en inflorescencias, diminutas y poco vistosas, que presentan polinización por hidrogamia (a través de las corrientes acuáticas), y que producen frutos y semillas tras la fertilización
03-11-2020 Playa de Cambriles.
|
|
|
|
|
|
De forma generalmente monoespecífica, algunas especies suelen formar “praderas” o “pastos”, esto es, comunidades con mayor o menor densidad de individuos que tapizan el lecho marino, desempeñando un importante papel en los ecosistemas cercanos a las costas hasta los 30 m de profundidad (zona fótica, meso e infralitoral). Estructuralmente son hábitats complejos y análogos a praderas terrestres, cuya complejidad se define según la cobertura de las plantas, y la densidad y el tamaño de sus haces, estando estrechamente relacionadas con los factores ambientales clave que determinan su crecimiento (sustrato, luz, nutrientes, temperatura, salinidad, hidrodinamismo, profundidad, etc.) (Pérez & al, 2015). Pero funcionalmente son análogos a hábitats de bosques tropicales por ser altamente productivos y albergar una enorme biodiversidad, siendo su importancia ecológica equivalente otros ecosistemas marinos, como los arrecifes de coral, bosques de laminarias o manglares. De esta manera, ayudan a numerosas especies a lo largo de parte o todo su ciclo de vida, a fijarse, alimentarse, reproducirse o refugiarse de los predadores.

Además, son plantas capaces de modificar el ambiente donde habitan y de aportar a la cimentación de su propio hábitat, como “ingenieras del ecosistema” (o bioconstructoras), ya que sus hojas ralentizan las corrientes y aumentan la sedimentación, ayudan a la captación de nutrientes, producen oxígeno y aumentan transparencia del agua, y sus raíces y rizomas estabilizan el sustrato de los fondos.

En síntesis, las angiospermas marinas forman hábitats muy relevantes por sus importantes funciones ecológicas, que proveen fundamentales bienes y servicios ecosistémicos de gran relevancia socioeconómica. Sustentan redes alimentarias marinas y proporcionan un hábitat esencial para muchas otras especies costeras, desempeñando un papel fundamental en el equilibrio de los ecosistemas costeros y los medios de vida humanos (Short & al, 2011). De esta forma, son la base ecosistémica de bancos pesqueros y de algunos usos agropecuarios tradicionales (funciones de aprovisionamiento), atenúan el hidrodinamismo en las costas por protección mecánica frente a la erosión del oleaje y son importantes en ciclos biogeoquímicos como en el secuestro de CO2 (ambas son funciones reguladoras), son importantes en el reciclado de nutrientes y como reserva de biodiversidad y reserva de resiliencia (funciones de apoyo), y aportan beneficios inmateriales relacionados con el enriquecimiento espiritual o intelectual (funciones culturales) (Mateo, 2015).
En general, los hábitats de angiospermas marinas se encuentran altamente amenazados y/o en peligro de desaparición por los impactos y las presiones causadas por las actividades antrópicas en zonas costeras, como por ejemplo, por la destrucción mecánica por arrastre de artes de pesca o anclas, por las diversas sustancias contaminantes vertidas, por la ocupación por infraestructuras costeras, por la competencia de especies exóticas o por el cambio climático. De hecho, por ser tan sensibles a estas perturbaciones, las praderas marinas son consideradas excelentes bioindicadores del estado de salud de los ecosistemas marinos costeros (Sánchez-Lizaso & al, 2015). Varios estudios han indicado que el hábitat de las angiospermas marinas está disminuyendo en todo el mundo, y que hasta diez de sus especies están en alto riesgo de extinción (14 % de todas las especies), con tres catalogadas como “En Peligro de Extinción” (Short & al, 2011). La pérdida de especies de plantas marinas y la degradación de la biodiversidad que albergan las praderas que forman, tendrá serias repercusiones para la biodiversidad marina global y las poblaciones humanas que dependen de los bienes y servicios ecosistémicos que proporcionan.
La conservación de los hábitats de angiospermas marinas comenzó a configurarse a través de la promulgación de distintas leyes, normativas y acuerdos nacionales e internacionales, junto a la promulgación de variadas figuras de conservación, como son los espacios naturales protegidos, lo que ayudó a aminorar las presiones directas sobre las praderas y/o preservar el buen estado de las mismas (Guillén & Otero, 2015). Pero es una realidad que las experiencias de gestión y conservación de estos ecosistemas ha sido sumamente heterogénea, con resultados muy diversos, desde altamente exitosos hasta totalmente ineficaces. Como ejemplo, en las costas del sur ibérico hace falta ejercer con mayor eficiencia y control las medidas promulgadas y realizar medidas de conservación en acción, tanto restrictivas como coactivas si fuera necesario. Por todo ello, es elemental llevar a cabo una gestión integral sostenible para el uso y la conservación de estos ecosistemas de praderas de plantas marinas.
Angiospermas marinas del litoral de Granada
Las especies de angiospermas (fanerógamas) marinas presentes en el litoral de la provincia de Granada son tres: Posidonia oceánica (familia Posidoniaceae), Cymodocea nodosa (familia Cymodoceaceae) y Zostera marina (familia Zosteraceae). Las podemos diferenciar según los siguientes caracteres diferenciales (Salazar, 2009):
- Rizomas gruesos enterrados (o semienterrados), no superficiales; rizomas y base de las hojas cubiertos de numerosas fibras membranáceas de color pardo; flores hermafroditas y frutos carnosos ____________ Posidonia oceánica (L.) Delile (“alga de vidrieros”, “posidonia”)
- Rizomas delgados, superficiales o enterrados a tramos; rizomas y base de las hojas no fibrosos; entrenudos largos y raíces en los nudos; flores unisexuales y frutos secos ______ 2
- Raíces ramificadas, hojas de 2-4 mm de anchura, de ápice obtuso y denticulado; flores femeninas con dos carpelos libres, flores masculinas con dos estambres ____________________ Cymodocea nodosa (Ucria) Ascherson (“alga”, “grama de mar”)
- Raíces simples, hojas de (3)5-12 mm de anchura, de ápice obtuso; flores femeninas con gineceo bicarpelar cenocárpico, flores masculinas con un estambre ____________________ Zostera marina (“hierba de mar”)
Cymodocea nodosa vuelve a brotar en nuestro litoral, sin embargo su recuperación peligra por las regeneraciones de playas.
En zonas muy localizadas de las costas de Almería también se presenta Zostera noltei Hornemann (= Nanozostera noltii (Hornem.) Toml. & Posl.) (Moreno & Guirado, 2003), especie que podría aparecer en Granada (cita no confirmada). Esta especie se diferencia de Z. marina por tener las hojas de los tallos vegetativos de hasta 1,5 mm de anchura, y de ápice truncado o emarginado.
|
|
|
Julio Peñas de Giles
Bibliografía
APG - Angiosperm Phylogeny Group (2016). An update of the Angiosperm Phylogeny Group classification for the orders and families of flowering plants: APG IV. Botanical Journal of the Linnean Society, 181 (1): 1-20. https://academic.oup.com/botlinnean/article/181/1/1/2416499
Akerman, J.D. 2006. Sexual reproduction of seagrasses: pollination in the marine context. In: Larkum, A.W.D., Orth, R.J. & Duarte, C.M. (eds.), Seagrass: Biology, Ecology and Conservation. Springer, Dordrecht, The Netherlands, 89-109.
den Hartog, C. & J. Kuo. 2006. Taxonomy and Biogeography of Seagrasses. In: Larkum, A.W.D., Orth, R.J. & Duarte, C.M. (eds.). Seagrass: Biology, Ecology and Conservation. Springer, Dordrecht, The Netherlands, 1-23.
Guillén, J. & M.M. Otero, 2015. Conservación y gestión. In: Ruiz, J.M., E. Guillén, A. Ramos Segura & M. Otero (eds.). Atlas de las praderas marinas de España. IEO/IEL/UICN, Murcia-Alicante-Málaga.
Les, D.H., Cleland & M.A. Waycott. 1997. Phylogenetic studies in Alismatidae. II. Evolution of marine angiosperms (seagrasses) and hydrophily. Systematic Botany, 22 (3). https://www.jstor.org/stable/2419820?seq=1#page_scan_tab_contents
Mateo, M.A. 2015. El valor de las praderas de angiospermas marinas. In: Ruiz, J.M., E. Guillén, A. Ramos Segura & M. Otero (eds.). Atlas de las praderas marinas de España. IEO/IEL/UICN, Murcia-Alicante-Málaga.
Moreno, D. & J. Guirado. 2003. Nuevos datos sobre la distribución de las fanerógamas marinas en las provincias de Almería y Granada (SE España). Acta Botánica Malacitana 28: 105-120.
Pérez, M., E. Díaz & J.M. Ruiz. 2015. Las angiospermas marinas. In: Ruiz, J.M., E. Guillén, A. Ramos Segura & M. Otero (eds.). Atlas de las praderas marinas de España. IEO/IEL/UICN, Murcia-Alicante-Málaga.
Ruiz, J.M., E. Guillén, A. Ramos Segura & M. Otero. 2015. Atlas de las praderas marinas de España. IEO/IEL/UICN, Murcia-Alicante-Málaga, 681 pp. http://www.ieo.es/documents/10192/26809/Atlas-praderas-marinas-de-Espa%C3%B1a-244-1.pdf/ee4e0dd6-e30c-443e-a6dd-14cc445068ad
Salazar, C. 2009. Posidoniaceae, Cymodoceaceae y Zosteraceae. In: Blanca, G., Cabezudo B., Cueto M., Fernández López C. & Morales Torres C. (2009, eds.). Flora Vascular de Andalucía Oriental, vol 1. Consejería de Medio Ambiente, Junta de Andalucía, Sevilla.
Sánchez-Lizaso, J.L., J.M. Ruiz & J. Bernardeau-Esteller. 2015. Causas del deterioro y pérdida de praderas marinas en España: el impacto del hombre. In: Ruiz, J.M., E. Guillén, A. Ramos Segura & M. Otero (eds.). Atlas de las praderas marinas de España. IEO/IEL/UICN, Murcia-Alicante-Málaga.
Short, F.T., Carruthers, T.J.B., Dennison, W. & Waycott, M. 2007. Global seagrass distribution and diversity: a bioregional model. Journal of Experimental Marine Biology and Ecology, 350, 1-2: 3-20. https://www.sciencedirect.com/science/article/pii/S002209810700305X
Short, F.T., Polidoro, B., Livingstone, S.R., Carpenter, K.E., Bandeira, S., Bujang, J.S., Calumpong, H.P., Carruthers, T.J.B., Coles, R.G., Dennison, W.C., Erftemeijer, P.L.A., Fortes, M.D., Freeman, A.S., Jagtap, T.G., Kamal, A.H.M., Kendrick, G.A., Kenworthy, W.J., La Nafie, Y.A., Nasution, I.M., Orth, R.J., Prathep, A., van Sanciangco, J.C., Tussenbroek, B., Vergara, S.G., Waycott, M., Zieman, J.C. 2011. Extinction risk assessment of the world’s seagrass species. Biological Conservation, 144: 1961-1971. https://www.sciencedirect.com/science/article/pii/S0006320711001327
Waycott, M., Procaccini, G., Les, D.H. & Reusch, T. 2006. Seagrass evolution, ecology and conservation: a genetic perspective. In: Larkum, A.W.D., Orth, R.J. & Duarte, C.M. (eds.), Seagrass: Biology, Ecology and Conservation. Springer, Dordrecht, The Netherlands, 25-50.







