Reino: Animal; Filo: Chordata; Subfilo: Vertebrata; Superclase: Gnathostomata; Superclase: ? Tetrapoda; Clase: Mammalia; Subclase: ? Theria; Orden: Cetartiodactyla; Suborden: Cetancodonta; Infraorden: Cetacea; Superfamilia Odontoceti; Familia: Physeteridae
Physeter macrocephalus Linnaeus, 1758
Cachalote, sperm whale
SITUACIÓN: Catálogo Andaluz de Especies Amenazadas: categoría “Vulnerable”
SINÓNIMOS: Catodon (Meganeuron) krefftii Gray, 1865; Catodon australis Wall, 1851; Catodon colneti Gray, 1850; Catodon macrocephalus Lacépède, 1804; Cetus cylindricus Billberg, 1828; Delphinus bayeri Risso, 1826; Phiseter cylindricus Bonnaterre, 1789; Phiseter mular Bonnaterre, 1789; Phiseter trumpo Bonnaterre, 1789; Physalus cylindricus Lacépède, 1804; Physeter andersonii Borowski, 1780; Physeter australasiensis Desmoulins, 1822; Physeter australis Gray, 1846; Physeter catodon Linnaeus, 1758; Physeter maximus G. Cuvier, 1798; Physeter microps Linnaeus, 1758; Physeter microps rectidentatus Kerr, 1792; Physeter novaeangliae Borowski, 1780; Physeter orthodon Lacépède, 1804; Physeter tursio Linnaeus, 1758; Physeterus sulcatus Lacépède, 1818; Tursio vulgaris Fleming, 1822
El nombre genérico deriva de la palabra griega “Physeter” y significa soplador y el específico “macrocephalus”, cabeza grande. Es el único miembro del género Physeter y junto al cachalote pigmeo (Kogia breviceps) ycachalote enano(Kogia sima) constituyen lafamilia Physeteridae. Se le conoce como “Sperm whale”,debido a que originalmente el spermaceti, sustancia cerosa semilíquida que se encuentra dentro de la cabeza, fue identificado erróneamente como semen por la gran semejanza con el líquido espermático. Y aunque se le llame “whale” (ballena), este cetáceo no un misticeto.
Descripción morfológica y anatómica:
Es el animal con dientes más grande que existe. Se encuentra entre los cetáceos que presentan un dimorfismo sexual más evidente en cuanto al en peso y longitud corporal, ya que los machos adultos pesan unas 3 veces más que las hembras y miden un 40% más. Al momento del nacimiento ambos sexos tienen casi el mismo tamaño(Shirihai & Jarrett, 2006), pero mientras que las hembras en edad adulta alcanzan unos 10,5-12 m de largo y 10-20 toneladas, los machos pueden medir entre 14-18 m y 35-55 toneladas (Rice, 1989; Cawardine, 2020).

El cuerpo macizo y fuerte, es de color pardo púrpura uniforme a gris oscuro (más claro en los ejemplares jóvenes), aunque con la luz del sol puede parecer marrón.A menudo presentan áreas blanquecinas en el vientre, la cabeza y alrededor de la mandíbula inferior. La piel que hay detrás de la cabeza y por los costados está llena de grandes arrugas horizontales. La cabeza del cachalote es grande con la frente plana, constituye un entre un 25-36% de la longitud total del cuerpo, tiene forma cuadrangular con un hocico romo que puede sobresalir hasta 1,5 m de la mandíbula inferior. Dentro contiene dos sacos gigantes llenos de aceite que pueden constituir hasta un cuarto de la masa corporal y ocupar un tercio de la longitud total del animal (Berzin, 1972; Clarke, 1978) que están limitados en ambos extremos por sacos de aire. El saco superior se denomina “órgano del espermaceti” debido al aceite de alta calidad que contiene. Este aceite se solidifica parcialmente en contacto con el aire y se vuelve blanco. El saco inferior, denominado “junk” (basura), localizado entre el órgano del espermaceti y la mandíbula superior, está lleno de un aceite más denso y está organizado en secciones por particiones transversales de tejido conectivo. El junk se asemeja al melón de los odontocetos (Heyning y Mead, 1990). El aceite de espermaceti, que tiene las propiedades de una cera, difiere químicamente de los aceites que se encuentran en los melones de la mayoría de los otros odontocetos. Se sabe que el órgano espermaceti es considerablemente más grande en relación con el tamaño del cuerpo en los machos que en las hembras (Cranford, 1999) y que es un órgano hidrostático muy sofisticado, que está relacionado con la capacidad de flotación y el sentido de ecolocalización (Fernández-Casado, 2000; Kiefner, 2002; Whitehead, 2018).Respecto al primero, se cree que el cachalote calienta o enfria, a voluntad, el aceite de espermaceti, aumentando o disminuyendo su densidad lo que le facilitaría la ascensión a superficie o la inmersión hacia zonas profundas (Cawardine, 1995; Kiefner, 2002). En la ecolocalización, el órgano actuaría como caja de resonancia en la producción de sonidos. Según algunos autores el órgano de espermaceti actúa además como apoyo del sistema circulatorio, ya que absorbería el exceso de nitrógeno en el transcurso de una prolongada apnea (Fernández-Casado, 2000; Cawardine 1995, 2020).
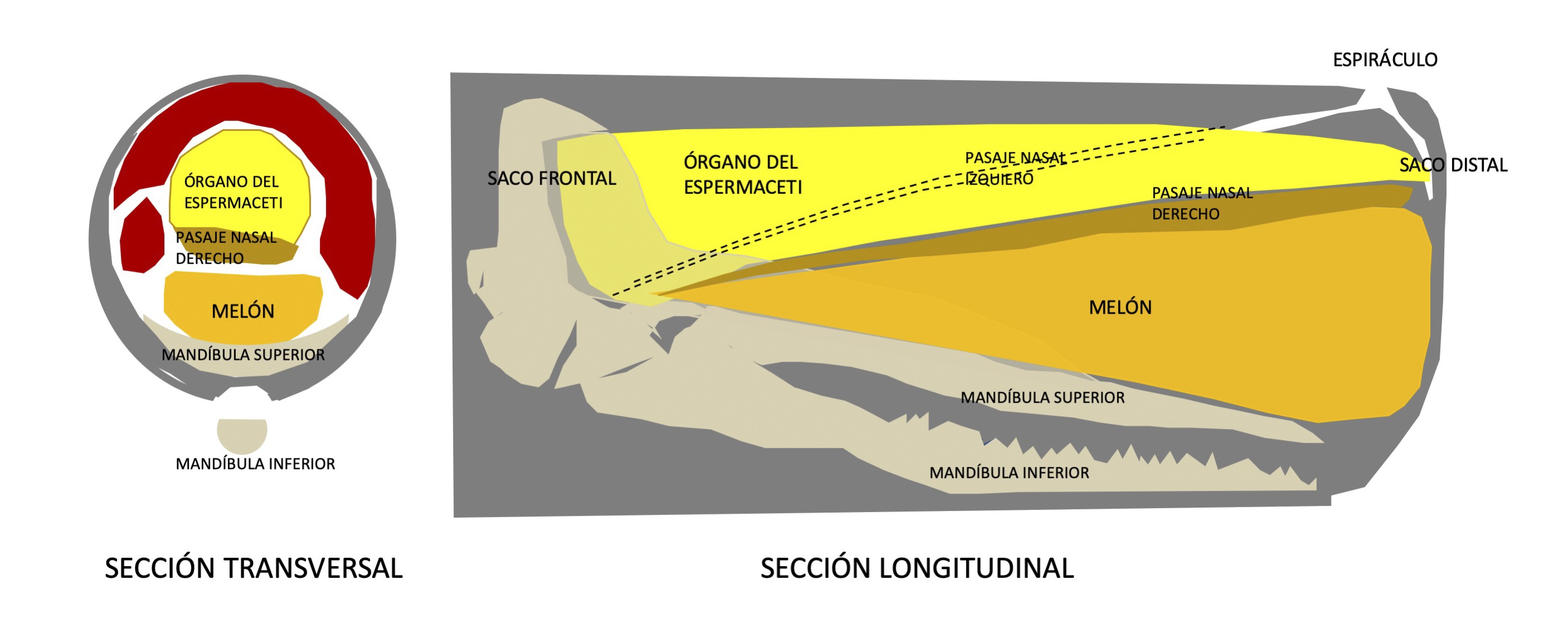
Además, la cabeza es asimétrica, siendo el lado derecho más largo que el izquierdo. La posición del aventador o espiráculo es excepcional, ya que está desplazado hacia la izquierda y hacia delante por lo que su soplo es inclinado hacia la izquierda. Es la única especie de odontoceto con dos orificios nasales, sin embargo, terminan en un único espiráculo, y no en dos como en los misticetos (Kiefner, 2002; Cawardine, 2020).
Algunos machos adultos tienen cicatrices o rasguños blancos en la cabeza, que son infectadas a menudo por diatomeas y por los piojos de las ballenas. Esas cicatrices pueden ser producidas por otros machos o por las ventosas de grandes cefalópodos. Presentan el cerebro más grande del reino animal (en las hembras es algo menor que en los machos).
Los labios superiores y la porción lingual de la mandíbula inferior son blancos y suele haber manchas blancas en vientre y flancos (Folkens, 2005).Tienen 20–26 dientes cónicos grandes en la mandíbula inferior y no parecen ser necesarios para la alimentación. Los dientes en la mandíbula superior parecen ser vestigiales y rara vez erupcionan(Gosho et al., 1984; Whitehead, 2018). Al cerrar la boca, los dientes encajan perfectamente en unos alvéolos presentes en la mandíbula superior (Fernández-Casado, 2000).
La aleta dorsal, pequeña y de forma triangular, con el vértice redondeado, es en general poco definida y está situada hacia la parte posterior del cuerpo, tras ésta aparecen una serie de 4 ó 5 pequeñas jorobas que terminan en el pedúnculo caudal (Fernández-Casado, 2000; Cawardine 1995, 2020).En ambos sexos, el número de protuberancias dorsales posteriores varía de uno a nueve, no aumenta con la edad, y tiene una frecuencia normal alrededor de cinco. En 0,7% de los machos se presentan de una a seis jorobas anteriores a la aleta dorsal, pero ninguna en las hembras (Kiefner, 2002; Cawardine, 2020). La aleta caudal es muy larga (25-28% de la longitud total del cuerpo), y tiene una muesca bien marcada que separa dos lóbulos muy anchos y de forma triangular. Las aletas pectorales son más bien cortas (9-10% de la longitud total), y con forma de paleta y presentan de 2-10 surcos profundos en la garganta(Fernández-Casado, 2000; Folkens, 2005).
Comportamiento
La unidad social básica de los cachalotes son los grupos estables de hembras de larga duración, lo que indica la relación matrilineal dentro de los grupos (Folkens, 2005). Los grupos sociales suelen ser de unos 20-25 animales normalmente y hay dos grupos principales, uno de “solteros” que son machos jóvenes (sexualmente inactivos) y otro denominado “grupos de cría”, formado por hembras con jóvenes de ambos sexos.
Dentro de los machos y en función de su edad se observa un gradiente de distribución; los machos jóvenes forman grupos de pocos individuos, mientras que los adultos, maduros físicamente, suelen ser solitarios. Estos últimos viajan hasta latitudes muy altas, mientras que los primeros suelen encontrarse, según la edad, en zonas de aguas templadas y frías. Los machos adultos pueden viajar en poco tiempo desde latitudes altas hasta aguas tropicales para aparearse en los grupos de hembras.
Debido a su gran cabeza y a su soplo inclinado hacia delante y hacia la izquierda, es uno de los cetáceos más fáciles de identificar en el mar, aunque en superficie sólo deje ver una mínima parte de su cuerpo. Un cachalote que descansa en la superficie parece un tronco enorme flotante. La manera de sumergirse y sus buceos extremadamente largos y profundos, permiten distinguirlos fácilmente de otros cetáceos.

Aunque generalmente se sumergen en busca de comida principalmente entre los 300 a 800 metros de profundidad, a veces descienden a profundidades comprendidas entre 1 a 2 kilómetros, en inmersiones que pueden durar más de una hora (Whitehead, 2003). En la superficie suele permanecer entre 7- 10 minutos aproximadamente antes de sumergirse con soplos cada 15-20 segundos aproximadamente. Su secuencia de inmersión comienza elevando la cabeza fuera del agua para seguidamente arquear su espalda y elevar la aleta caudal por encima de la superficie.
Entre las adaptaciones al buceo que presenta esta especie está la capacidad de regular su flotabilidad gracias al órgano del espermaceti. Otra adaptación es la existencia de una potente “rete mirabile”, que consiste en una red compleja de arterias y venas que funcionan como intercambiadores de calor, pudiendo regular la temperatura de su cabeza independientemente de la del cuerpo. Otra adaptación fisiológica es que, a diferencia de los humanos, su reflejo de respiración no se desencadena por una cierta concentración de dióxido de carbono en la sangre. Ellos necesitan respirar cuando detectan que el oxígeno se acaba. De esta manera hacen un uso más efectivo del oxígeno disponible que otros mamíferos terrestres que sienten la necesidad de respirar mucho antes de que el oxígeno en sus sistemas haya sido consumido. Mientras que un humano solo puede intercambiar entre un 10-15% del aire de sus pulmones con cada respiración, los cachalotes consiguen hasta un 90%. Aunque la cantidad de sangre es relativamente pequeña´, la concentración de hemoglobina en sangre es mayor que en mamíferos terrestres, y su función es más de transportar el oxígeno que de almacenarlo. Además, la capacidad de transportar oxígeno que tiene la mioglobina en los mamíferos marinos, es superior que en los terrestres (Kiefner, 2002). La reducción del metabolismo y la bradicardia también son algunas de las adaptaciones de estos grandes mamíferos al buceo. Solo los órganos vitales como el corazón, el cerebro y la médula espinal son suministrados continuamente de oxígeno durante el buceo (Kiefner, 2002). Según Terry Williams, 2002, un zoólogo de la Universidad de California, las ballenas bucean de una manera muy relajada. En vez de impulsarse, se dejan caer hasta el fondo como rocas inmóviles. De esta manera reducen notablemente el gasto energético que supondría la impulsión.
Los cachalotes son la única especie de cetáceo que contienen una sustancia muy inusual en sus intestinos denominada “ámbar gris”. El ámbar gris es una sustancia rara producida en los intestinos de los cachalotes. Parece ser el resultado de una irritación causada por los picos de los cefalópodos de los que se alimentan. El mecanismo por el cual se produce el ámbar gris, se ha abordado a lo largo de la historia, pero debido a informes contradictorios y explicaciones fantasiosas sobre su origen, solo recientemente ha sido ampliamente aceptado (Brito et al., 2016). Se trata de una sustancia oscura como cera con un olor desagradable en una dosis altamente concentrada. Al secarse su color se vuelve más claro, ligero en densidad y con olor a almizcle. Es muy preciado por su uso en la industria de perfumes y muy valioso. A veces se han confundido con excrementos, ya que son encontrados en los intestinos de cachalotes muertos o bien como restos flotantes (Kiefner, 2002; Cawardine, 2020).La mayoría del ámbar gris se encuentra en el intestino grueso o el recto. Es bastante raro y se puede encontrar solo en unos pocos cachalotes (Rice, 2009).
Entre la base del órgano de espermaceti y el espiráculo, existen dos canales nasales de diferente longitud. Se piensa que el cachalote utiliza el canal izquierdo, más largo, para respirar, y el derecho para la producción de sonido (Norris, 1972; Fernández-Casado, 2000; Cawardine, 2020).
Se ha demostrado que los cachalotes pueden producir clics direccionales de alta intensidad que son lo suficientemente intensos para su uso en ecolocalización y alimentación (Møhl et al., 2000; Miller et al., 2004). Los clics de cachalote suelen oscilar entre 400 Hz y al menos 15 kHz (Goold y Jones, 1995).Emiten diversas vocalizaciones, además de una serie de chasquidos que pueden usar para comunicarse o para la ecolocalización(Frankel, 2009).
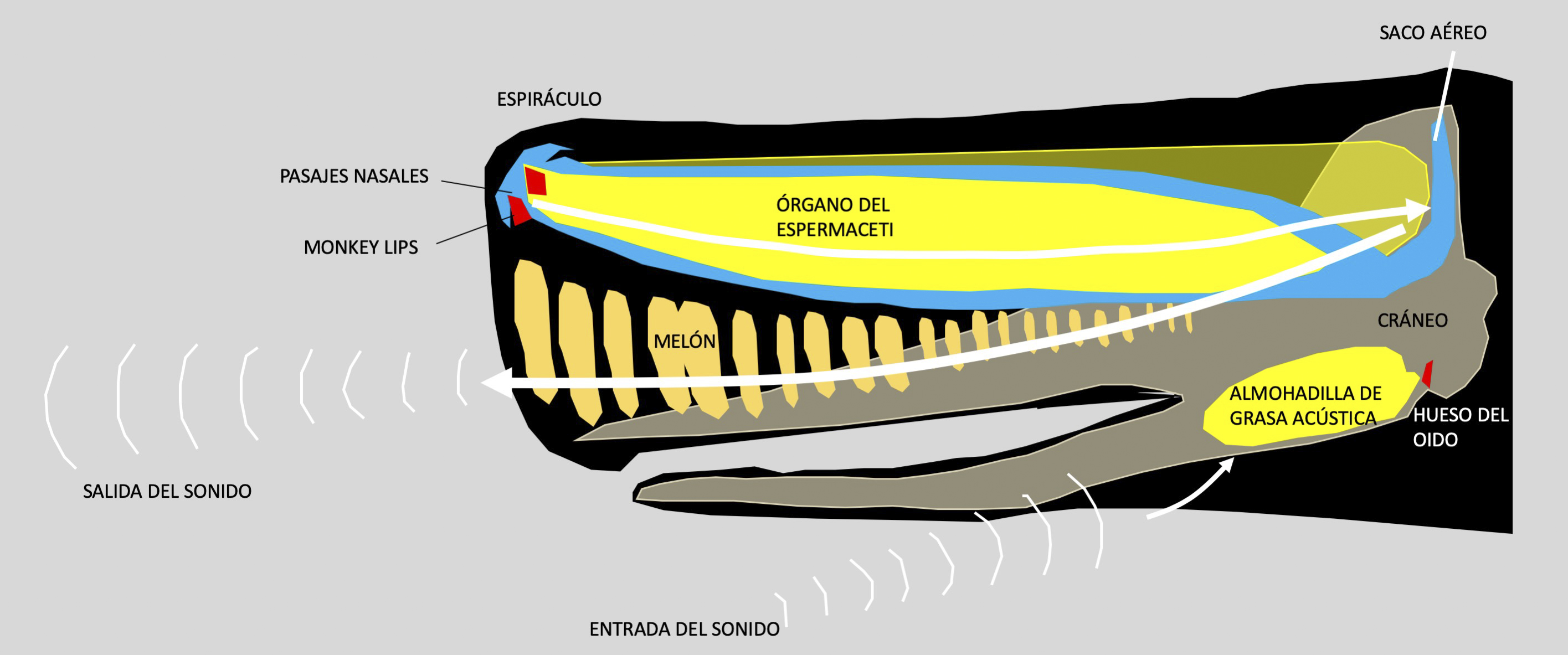
Redibujado de Whale Watching Azores
Alimentación y Reproducción
El cachalote es el depredador más grande que existente. Las presas son de hábito bentónico o pelágico y son atrapadas en aguas comprendidas entre los 400-1200 m de profundidad (Martin & Clarke, 1986). Se alimentan de varias especies, de las cuales la más notables es el calamar gigantey diversos peces demersales, pero la mayor parte de su dieta consiste en calamaresde mediano tamaño (Whitehead, 2003). Pueden llegar a ingerir un 3-3,5% de su peso diariamente (Clarke et al., 1993; Folkens, 2005; Whitehead, 2018).Sólo en aguas subpolares boreales (en el Atlántico y en el Pacífico), los peces pueden superar a los calamares en la dieta de los grandes machos adultos, superando a veces el 90% del total. También parece posible, aunque menos frecuente, que se alimente de alguna especie demersal de escualo (Fernández-Casado, 2000).
Debido al lento proceso de maduración y a los largos periodos entre embarazos, las poblaciones de esta especie crecen muy despacio y les cuesta mucho recuperarse de la sobreexplotación (Folkens, 2005).Los apareamientos tienen lugar en aguas tropicales y subtropicales, desde mediados de invierno a principios de la primavera o hasta mediados del verano (Kiefner, 2002; Folkens, 2005). Los jóvenes nacen, casi siempre solos y con una proporción de sexos igual, después de una gestación de aproximadamente 14-16 meses (Best et al., 1984).Aunque los cachalotes pueden comer alimentos sólidos antes de su primer año, continúan amamantando durante varios años.
Las hembras alcanzan la madurez sexual aproximadamente a los 9 años cuando tienen aproximadamente 9 m de longitud, a partir de las cuales el crecimiento comienza a disminuir (Best et al., 1984).Paren aproximadamente una vez cada 4-6 años, aunque se ha encontrado que las tasas de embarazo varían entre áreas y en la misma área en diferentes etapas de explotación por parte de los humanos. Las tasas de reproducción femenina disminuyen con la edad, y muy pocas dan a luz después de los 40 años (Whitehead, 2018).
Distribución y Migración
Los cachalotes se encuentran por todo el mundo en todos los océanos desde el extremo polar hasta el ecuador en ambos hemisferios(Rice 1989). Prefieren las zonas templadas y las zonas aledañas a pendientes y cañones submarinos. El patrón de migración de esta especie difiere del de otros cetáceos migratorios. Es diferente en machos y hembras. Sólo los machos migran estacionalmente de aguas polares a aguas tropicales de ambos hemisferios. Las hembras y sus crías permanecen todo el año en aguas tropicales y subtropicales, no migran, siempre permanecen entre los 40º de latitud norte y 40º de latitud sur.Los machos migran a latitudes más altas, solos o en grupo, y vuelven al ecuador para reproducirse. En algunas latitudes medias parece haber una migración general estacional de norte a sur, con los machos moviéndose hacia los polos en verano, pero, en las zonas ecuatoriales y algunas zonas templadas, no existe una migración estacional clara (Whitehead, 2003).Algunas poblaciones pueden permanecer todo el año en el mismo lugar y otras, sin embargo, moverse en busca de alimento.
Su distribución en aguas Atlánticas es amplia. En el Mediterráneo se encuentran abundancias relativas más altas en la cuenca occidental, particularmente en el área del Golfo de Leones y cerca de las Islas Baleares, donde los cachalotes pueden alimentarse y / o reproducirse. En el Mediterráneo oriental, las islas griegas parecen ser frecuentadas también por grupos mixtos (Gannier et al., 2002).Nunca han sido vistos en el Mar Negro(Shirihai & Jarrett, 2006)y su presencia el Mar Rojo es incierta (Taylor et al., 2008).
En el Estrecho de Gibraltar es una especie semi-residente y suele localizarse mayoritariamente en las zonas más profundas, donde probablemente se ubiquen los calamares de mayor tamaño, de los cuales se alimenta. Se observan con mayor frecuencia desde mediados de primavera hasta principios del verano (entre los meses de mayo y julio), aunque es posible verlos a lo largo de todo el verano, repuntando de nuevo a finales. Al parecer comparten territorios de superficie comunes con otras especies de cetáceos, especialmente con las ballenas piloto de aletas largas (Globicephala melas). La distribución vertical de estas dos especies durante la caza, y probablemente una parte clara de la columna de agua, se puede evaluar localizando a los animales utilizando acústica pasiva(de Stephanis et al., 2008). En sus observaciones, se suelen utilizar los bordes irregulares de las aletas caudales como criterio de identificación individual.
Amenazas
Las orcas suponen una amenaza natural para estos grandes cetáceos, ya que éstas intentar aislar a las crías, atacando a los grupos de hembras donde se encuentran. Como respuesta a estos ataques, las hembras se colocan en lo que se conoce como “formación margarita”, de tal manera que se disponen en círculo con las cabezas hacia dentro, donde resguardan a las crías, y con las colas hacia fuera (Kinze, 2002; Ross, 2007).

Esta formación en margarita se emplea también para auxiliar a un miembro lesionado de la manada, un comportamiento que los primeros balleneros utilizaron para atraer a los otros miembros del grupo al causarle heridas a cualquiera de los individuos (Ross, 2007).
Durante los siglos XVIII, XIX y XX, el cachalote fue cazado intensamente para obtener el espermaceti y otros productos como aceite y ámbar gris. Pero los cachalotes no solo eran apreciados por los balleneros por el aceite de alta calidad contenido en el órgano de espermaceti, los balleneros también los temían por su comportamiento agresivo. La novela ficticia Mobby Dick de Herman Melville (1851), en la que se relata el hundimiento del Pequod, se inspiró en los casos en que los grandes cachalotes atacaron, y en varios casos hundieron, los barcos balleneros embistiendo los barcos con sus cabezas (Starbuck, 1878; Philbrick, 2000).
|
|
|
Como resultado de la caza intensiva su número se redujo sustancialmente. La explotación comercial de cachalotes, que ha sido extensa (Rice 1989), terminó en 1988 como resultado de las regulaciones internacionales. Aunque no hay estimaciones de población confiables, las poblaciones actuales se consideran agotadas en comparación con las que precedieron a la explotación (Klinowska, 1991; Whitehead, 1995). Entre las amenazas que sufre esta especie se encuentran aquellas que resultan en la mortalidad directa del cachalote, como la captura incidental en redes de deriva ilegales y colisiones con barcos, junto con los efectos nocivos del ruido, la contaminación, la ingestión de desechos sólidos, la perturbación de las operaciones irresponsables de observación de cetáceos, y posiblemente el agotamiento de las presas y el cambio climático, afectan la supervivencia de la población mediterránea y son la causa de una disminución continua inferida (Notabartolo di Sciara, 2014). El intenso tráfico marítimo es una causa potencialmente significativa de mortalidad para los cachalotes en el Mediterráneo debido a colisiones entre éstos y grandes embarcaciones (de Stephanis et al., 2003, 2005).Los desechos sólidos, en gran parte de plástico, a menudo se encuentran en el tracto digestivo de los cachalotes varados, a veces con consecuencias fatales (Jacobsen et al., 2010).
A nivel mundial, la población de cachalotes según la IUCN (Unión Internacional para la Conservación de la Naturaleza), es vulnerable.En el mar Mediterráneo, considerada una población genéticamente distinta de los congénitos del Atlántico, (Drouot et al., 2004; Engelhaupt et al., 2009) se cree que contienen menos de 2500 individuos maduros, por lo que esa subpoblación se encuentra actualmente “En Peligro” en la Lista Roja de Especies Amenazadas de la UICN (Notarbartolo di Sciara & Fratzis, 2012). Las recomendaciones para mantener la presencia de cachalotes en el Mediterráneo en el futuro incluyen respetar las regulaciones existentes de pesca, contaminación y observación de ballenas, e introducir regulaciones precautorias de ruido y tráfico marítimo en áreas caracterizadas por altas densidades de cachalotes (Notarbartolo di Sciara, 2014).
En el Mar de Alborán, se distribuye por las aguas profundas del talud continental donde son más abundantes los calamares mesopelágicos, su presa favorita. En el Estrecho de Gibraltar se han visto individuos repetidamente a lo largo de varios años. En el mar de Alborán y Estrec
ho de Gibraltar solo se han observado machos adultos y/o subadultos, pero nunca grupos sociales ni crías. La zona de observación de grupos de hembras con crías y juveniles más cercana es alrededor de las islas Baleares. En el Mediterráneo era más abundante en el pasado y con un rango de distribución más amplio. La densidad parece ser mayor en la cuenca occidental del Mediterráneo que en la oriental. En el Mediterráneo, el Instituto Hidrográfico de la Marina a instancias del Ministerio de Medio Ambiente español publicó en 2007 un “Aviso a marineros” que recomienda, entre otras cosas, limitar la velocidad de los grandes barcos a 13 nudos en la zona del Estrecho de Gibraltar con mayor densidad de cachalotes, con el fin de evitar los riesgos de colisión (https://www.iucn.org).
MÁS INFORMACIÓN
VÍDEOS
Estrecho de Gibraltar
REFERENCIAS BIBLIOGRÁFICAS
- Berzin, AA. (1972). The Sperm Whale. Jerusalem: Israel Program for Scientific Translations.
- Best, PB., Canham, PAS. & Macleod, N. (1984). Patterns of reproduction in sperm whales, Physeter macrocephalus. Rep. Int. Whaling Comm. 6 (Special Issue), 51–79.
- Brito, C., Jordão, VL. & Pierce, GJ. (2016). Ambergris as an overlooked historical marine resource: its biology and role as a global economic commodity.Journal of the Marine Biological Association of the United Kingdom,96(3), 585-596.
- Cawardine, M. (1995). Ballenas, Delfines y Marsopas. Guía visual de todos los cetáceos del mundo. Ediciones Omega, S.A., 256 pp.
- Cawardine, M. (2020). Handbook of Whales, Dolphins, and Porpoises of the World. Bloomsbury Wildlife, London, 528 pp.
- Clarke, MR. (1978). Structure and proportions of the spermaceti organ in the sperm whale. Journal of the Marine Biological Association of the United Kingdom, 58(1), 1-17.
- Clarke, MR., Martins, HR. & Pascoe, P. (1993). The diet of sperm whales (Physeter macrocephalusLinnaeus 1758) off the Azores. Philosophical Transactions of the Royal Society of London. Series B: Biological Sciences, 339 (1287), 67-82.
- Cranford, TW. (1999). The sperm whale’s nose: sexual selection on a grand scale? Mar. Mammal Sci. 15, 1133–1157.
- De Stephanis, R., Salazar Sierra, J., Perez Gimeno, N., Verborgh, P., Tellez, E. & Rueda, L. (2003). Collision between a ferry and a sperm whale (Physeter macrocephalus) in the Strait of Gibraltar. European Research on Cetaceans, 17, 227.
- De Stephanis, R., Verborgh, P, Pérez Gimeno, N., Sánchez Cavanes, A., Perez ´ Jorge, S., Esteban Pavo, R., Seller, N., Urquiola, E. & Guinet, C. (2005). Impactos producidos por el tráfico marítimo en las poblaciones de cetáceos en el Estrecho de Gibraltar. Situación actual y previsiones de futuro. Dirección General para la Biodiversidad del Ministerio ´ de Medio Ambiente 140 pp.
- De Stephanis, R., Cornulier, T., Verborgh, P., Sierra, JS., Gimeno, NP. & Guinet, C. (2008). Summer spatial distribution of cetaceans in the Strait of Gibraltar in relation to the oceanographic context. Marine Ecology Progress Series, 353, 275-288.
- Drouot, V., Goold, JC., & Gannier, A. (2004). Regional diversity in the social vocalizations of sperm whale in the Mediterranean Sea. Revue d'écologie.
- Engelhaupt, D., Rus Hoelzel, A., Nicholson, C., Frantzis, A., Mesnick, S., Gero, S., Whitehead, H, Rendell, L, Miller, P, De Stephanis, R., Cañadas, A., Airoldi, S. & Mignucci-Giannoni, AA. (2009). Female philopatry in coastal basins and male dispersion across the North Atlantic in a highly mobile marine species, the sperm whale (Physeter macrocephalus). Molecular Ecology, 18(20), 4193-4205.
- Folkens, PA. & Reeves, RR. (2005). Guía de los mamíferos marinos del mundo(No. Sirsi) i9788428213158). National Audubon Society.
- Frankel, AS. (2009). Sound production. In Encyclopedia of marine mammals(pp. 1056-1071). Academic Press.
- Gannier, A., Drouot, V. & Goold, JC. (2002). Distribution and relative abundance of sperm whales in the Mediterranean Sea. Marine Ecology Progress Series, 243, 281-293.
- Goold, JC. & Jones, SE. (1995). Time and frequency domain characteristics of sperm whale clicks. The Journal of the Acoustical Society of America, 98(3), 1279-1291.
- Gosho, ME, Rice, DW & Breiwick, JM (1984). El cachalote, Physeter macrocephalus. Marine Fisheries Review,46(4), 54-56.
- Heyning, JE. & Mead, JG. (1990). Evolution of the nasal anatomy of cetaceans. In Sensory Abilities of Cetaceans (ed. J. Thomas and R. Kastelein), pp. 67–79. New York: Plenum Press.
- Jacobsen, JK., Massey, L. & Gulland, F. (2010). Fatal ingestion of floating net debris by two sperm whales (Physeter macrocephalus). Marine Pollution Bulletin, 60(5), 765-767.
- Kiefner, R. (2002). Whales & dolphins. Cetacean world guide. Hackenheim,Germany: IKAN-Unterwasserarchiv.
- Kinze, CC. (2002). Mamíferos marinos del Atlántico y del Mediterráneo. Omega.
-Klinowska, M. 1991 Dolphins, porpoises and whales of the world. The IUCN red data book. Gland and Cambridge: IUCN.
- Martin, AR., & Clarke, MR. (1986). The diet of sperm whales (Physeter macrocephalus) captured between Iceland and Greenland. Journal of the Marine Biological Association of the United Kingdom,66(4), 779-790.
- Miller, PJ., Johnson, MP. & Tyack, PL. (2004). Sperm whale behaviour indicates the use of echolocation click buzzes ‘creaks’ in prey capture. Proceedings of the Royal Society of London. Series B: Biological Sciences, 271(1554), 2239-2247.
- Møhl, B., Wahlberg, M., Madsen, PT., Miller, LA., & Surlykke, A. (2000). Sperm whale clicks: Directionality and source level revisited. The journal of the Acoustical Society of America, 107(1), 638-648.
- Norris, KS. & Harvey, GW. (1972). A theory for the function of the spermaceti organ of the sperm whale (Physeter catodon L.).
- Notarbartolo-di-Sciara, G. & Frantzis, RL. (2012). Sperm Whales in the Mediterranean: The Difficult Art of Coexisting With Humans in a Crowded Sea. Whalewatcher. J. Am. Cetacean Soc, 41(1), 30-38.
- Notarbartolo di ‐ Sciara, G. (2014). Cachalotes, Physeter macrocephalus, en el Mar Mediterráneo: un resumen del estado, las amenazas y las recomendaciones de conservación. Conservación acuática: ecosistemas marinos y de agua dulce, 24 (S1), 4-10.
- Philbrick, N. (2000). In the Heart of the Sea. Harmondsworth, UK: Penguin Books Ltd.
- Rice, DW. (1989). Sperm whale Physeter macrocephalusLinnaeus, 1758. Handbook of marine mammals, 4, 177-233.
- Rice, DW. (2009). Ambergris. In Encyclopedia of Marine Mammals(pp. 28-29). Academic Press.
-Ross, P. (2007), Extraordinary Animals: An Encyclopedia of Curious and Unusual Animals, Greenwood Press.
- Shirihai, H. y Jarrett, B. (2006). Whales Dolphins and Other Marine Mammals of the World. Princeton: Princeton Univ. Press. pp. 21-24.
- Starbuck, A. (1878). History of the American Whale Fishery, from its Earliest Inception to the Year 1876. New York: Argosy-Antiquarian Ltd.
- Whitehead, H. (1995). Status of Pacific sperm whale stocks before modern whaling. Rep. Int.Whal. Commn 45, 407-412.
- Whitehead, H. (2003). “Sperm Whales: Social Evolution in the Ocean”. University of Chicago Press, Chicago.
- Whitehead, H. (2003). «The Diet of a Sperm Whale: The Walnut, the Pea and the Half-Pound Steak». Sperm Whales Social Evolution in the Ocean. University of Chicago Press. pp. 43-55
- Whitehead, H. (2003). «Vertical Movements: The Sperm Whale's Dive». Sperm Whales Social Evolution in the Ocean. University of Chicago Press. p. 79.
- Whitehead, H. (2018). Sperm whale: Physeter macrocephalus. In Encyclopedia of marine mammals (pp. 919-925). Academic Press.
- Williams, TM. & Worthy, GA. (2002). Anatomy and physiology: the challenge of aquatic living. Marine mammal biology: An evolutionary approach, 73-97.
PÁGINAS WEB
https://www.iucn.org/sites/dev/files/import/downloads/ficha_cachalote.pdf
https://www.miteco.gob.es/es/costas/publicaciones/bm_bbdd_inventario_atlanticas_tcm30-161265.pdf
LILIANA OLAYA PONZONE



