La falta de protección causada por la pérdida, total o parcial, de la concha, les ha obligado a desarrollar diferentes sistemas de defensa, los cuales pueden combinar o cambiar, en función de su estado de desarrollo. La estrategia más eficaz para no caer en manos de un depredador es no ser detectado. Por ello, muchos opistobranquios utilizan el mimetismo y la cripsis o camuflaje (imitar la coloración y forma del sustrato, como primera barrera defensiva,). En nuestro litoral podemos encontrar múltiples ejemplos, como es el caso del anaspideo Petalifera petalifera, que vive en las hojas de Posidonia oceanica y de las que resulta difícil de diferenciar debido a su coloración verdosa. Otro ejemplo lo tenemos en los sacoglosos, los cuales suelen presentar una coloración similar al alga sobre la que viven y se alimentan. En la fotografía cuesta diferenciar, a pesar del aumento de la imagen, los dos ejemplares de Elysia viridis sobre el fondo verde de un alga del género Codium. Dentro de los nudibranquios, muchos doridáceos poseen una coloración similar a la esponja de la que se alimentan.
|
|
|
Un caso típico de cripsis es la del dendronotáceo Tritonia nilsodhneri, este pequeño nudibranquio vive enrollado sobre las ramas de gorgonias del género Leptogorgia o Eunicella, a las que copia el color (en el caso de gorgonias de color rojo, la coloración del nudibranquio es casi negra, ya que el rojo es absorbido en los primeros diez metros de profundidad) y además las ceratas o proyecciones dorso-laterales imitan a los pólipos de la gorgonia .
Con la misma finalidad de no ser detectados, algunas especies, como la vaquita suiza Peltodoris atromaculata, presentan colores disruptivos que dificultan su localización.
|
|
Si son localizados, entran en juego otros sistemas defensivos, que los podemos clasificar en mecánicos o químicos. Los primeros consisten en la presencia de estructuras puntiagudas que disuadan al depredador al morder a su presa, mientras que las segundas se basan en la emisión de sustancias con mal sabor, tóxicas o con pH muy bajos, adquiridas en ocasiones a través de la alimentación.

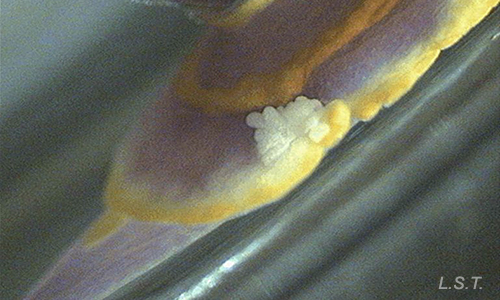
Éstas sustancias suelen ser liberadas por glándulas situadas en el borde del manto, como las formaciones dérmicas del manto de los cromodóridos, o en la parte dorsal del mismo.
|
|
|
Las especies con estos sistemas de defensa, en vez de intentar pasar desapercibidos, suelen presentar coloraciones muy llamativas (coloraciones aposemáticas), que avisan a sus depredadores de su mal sabor, toxicidad, etc. Sin embargo, si todos los peces tuvieran que aprender de uno en uno, que esos animales con colores tan llamativos no son un buen alimento, los pocos opistobranquios que sobrevivieran al aprendizaje estarían seriamente dañados. Por suerte para ellos, cuando un pez muerde a un opistobranquio con defensas químicas, rápidamente lo expulsa y los peces de su grupo, o los que están alrededor, aprenden también que estos pequeños y vistosos animales no son tan buenos como parecen.
|
|
Aprovechándose de estas señales de aviso y del aprendizaje de los depredadores, algunas especies se asocian en lo que se conoce como círculo Mülleriano (mimetismo Mülleriano). En la imagen podemos ver seis especies del género Felimare de nuestro litoral, con un patrón de coloración similar que, a ojos de un neófito y más a los de un pez, les hacer parecer iguales. Además, una de ellas, Felimare fountandraui, explota más esta circunstancia al carecer de sistemas químicos de defensa y, por tanto, ahorrarse el gasto energético que esto supone (mimetismo batesiano).

Un tipo de defensa física, que poseen muchos doridáceos, son los tubérculos cariofílideos, pequeñas protuberancias rodeadas de espículas puntiagudas, que dan al animal una textura rasposa que puede disuadir al depredador.
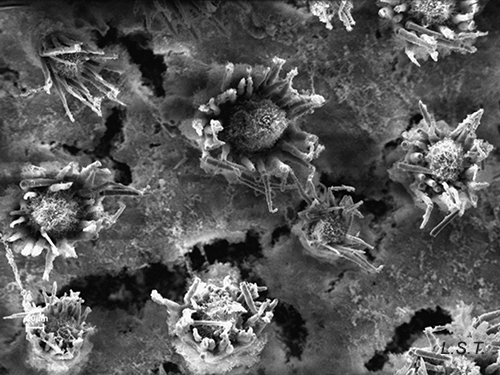
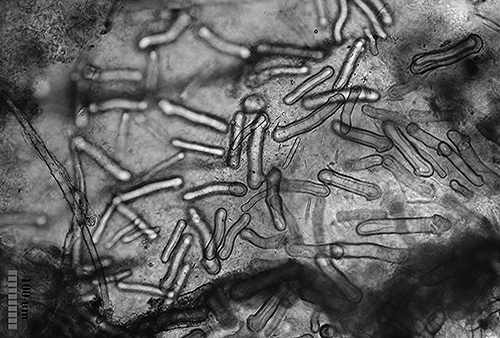
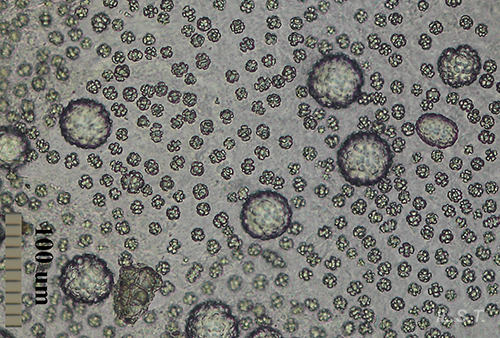
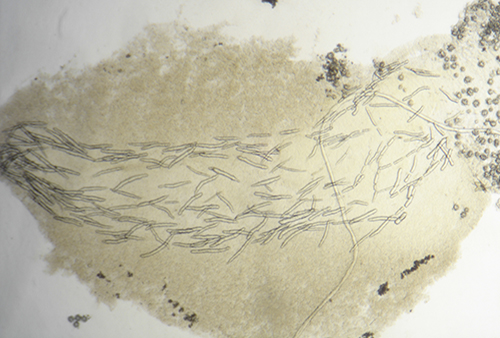
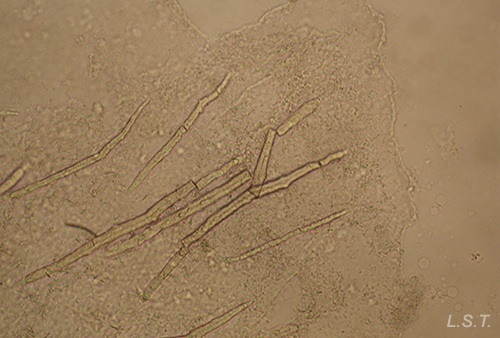
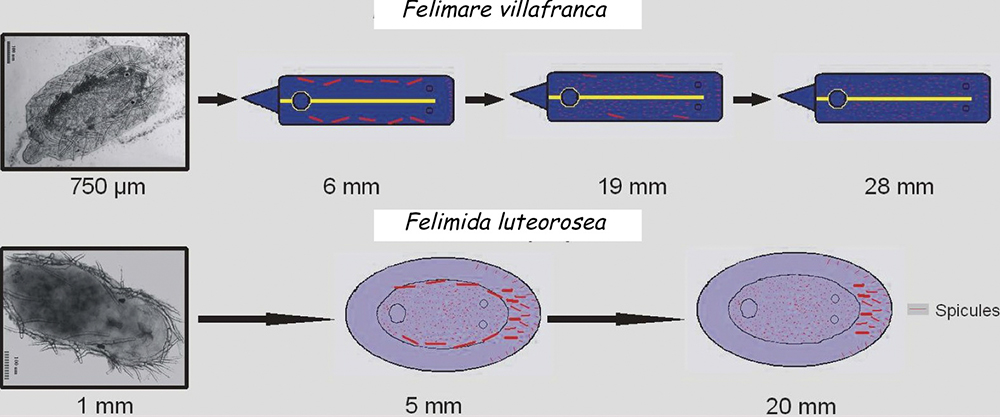
En otros casos las espículas, también con función disuasoria, están embebidas en la pared del cuerpo, principalmente en el borde del manto, rinóforos y parte final del pie. Este tipo de defensa la poseen los juveniles de algunos géneros de doridáceos, en general, aposemáticos. Por ejemplo Felimare, Felimida y Dendrodoris. Sin embargo, en los adultos de estos géneros, ya con sistemas químicos desarrollados, han desaparecido prácticamente las espículas del manto y sólo quedan las de los rinóforos y parte final del pie. En algunas especies del género Felimare: F. bilineata y F. villafranca, las espículas puntiagudas y de gran tamaño del manto son sustituidas por otras más numerosas, de un tamaño inferior a 100 μm. y con los extremos romos. Algo similar ocurre en Felimida purpurea, F. luteorosea, F. Krohni y F. binza, pero en estas especies las espículas son esféricas, de un tamaño inferior a 50 μm y están embebidas en una especie de lámina que se encuentra en la pared interna del cuerpo. Una posible explicación a estos cambios, en disposición forma y tamaño a lo largo de su desarrollo, es que cuando son juveniles y no han desarrollado todavía las defensas químicas y la coloración aposemática, la forma más efectiva de defensa, una vez que son capturados, es disuadir a su depredador pasando por un alimento con una textura poco agradable. Cuando ya han adquirido las defensas químicas y la coloración aposemática o de aviso, el mantener estas estructuras disuasorias puede dar lugar a un gasto innecesario de energía.
|
|
|
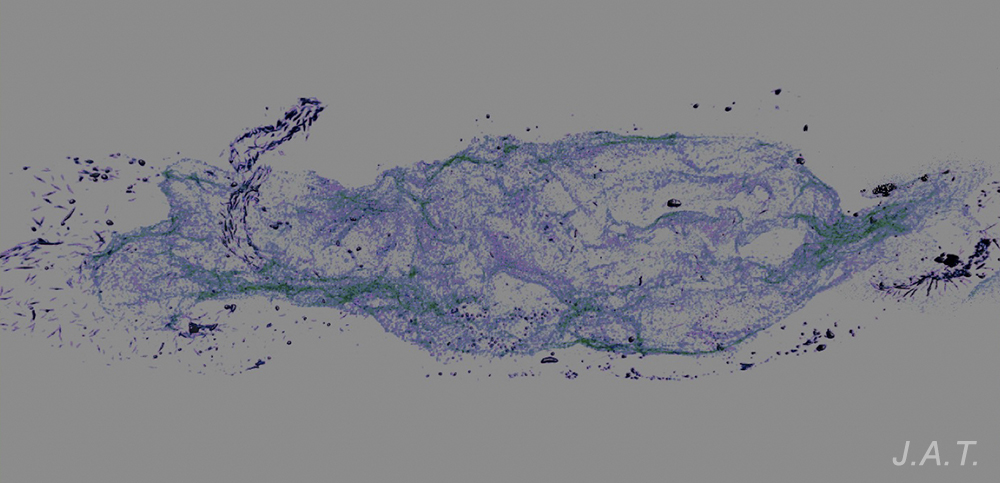
Sin embargo nos pueden surgir un par de preguntas: ¿Por qué conservan las espículas de los rinóforos y las del final del pie? y ¿Cuál es la función de las numerosas espículas de pequeño tamaño que desarrollan en esta etapa?. Para contestarlas nos tenemos que fijar en como se comporta un doridáceo ante el ataque de un depredador. Su primera reacción es introducir las branquias en la cavidad branquial, mientras que los rinóforos, que son su medio de comunicación con el entorno, permanecen expuestos en el exterior. Éstos, al igual que la parte posterior del pie, son muy vulnerables al ataque, por lo que no les viene mal poseer el tacto espinoso que les proporcionan las espículas. Si el depredador sigue insistiendo, el nudibranquio se contrae, hasta llegar a reducirse hasta la mitad de su tamaño en reposo, y es en este momento donde entran en juego las numerosas y pequeñas espículas, ya que al juntarse forman una fuerte armadura interna, que protege a las vísceras de posibles daños causados por el depredador, antes de que éste lo escupa a causa las defensas químicas.
|
|
|
|
|
|
|
|
Otra especie en la que hemos observado una evolución en la espículas a lo largo de su desarrollo, es Polycera quadrilineata, pequeño doridáceo con una coloración blanca y amarilla muy llamativa.
En el vídeo se observan por transparencia las espículas de un juvenil de P. quadrilineata.
En la siguiente imagen se aprecia claramente las diferencias entre un ejemplar de 3 mm., uno de 12 y otro 17.

Las espículas de Polycera quadrilineata se disponen formando una especie de armadura que rodea la masa visceral, con la partes puntiagudas hacia el exterior.
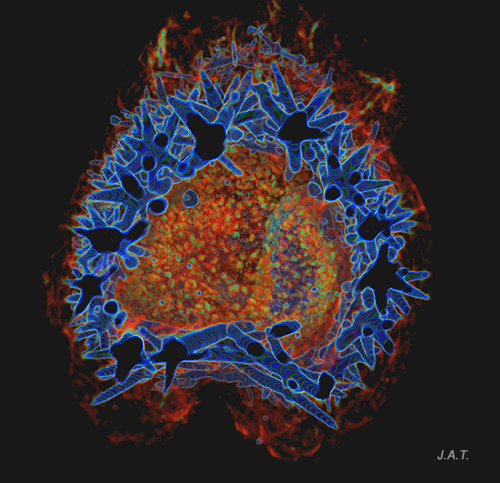
Algunas especies, como Tambja ceutae, escapan de sus depredadores, en esta caso Tyrannodoris europaea, nadando gracias a bruscos movimientos que realizan con el cuerpo.
Un sistema muy elaborado de defensa es el que presentan los aeolídidos. En general se alimentan de cnidarios, y no sólo burlan el sistema de defensa de éstos, sino que lo hacen suyo al almacenar los cnidocitos en los extremos de sus ceratas o proyecciones dorsolaterales, que se encuentran conectadas con el digestivo. Ante el ataque de un depredador, suelen contraerse y presentarle los ceratas como si fueran los tentáculos de una anémona, e incluso pueden desprenderse de ellos y posteriormente regenerarlos.
Resumiendo mucho los trabajos de Greenwood, 2009; Goodheart & Bely, 2017 y Goodheart et al., 2018, el proceso de forma muy general es el siguiente: "Para evitar el daño que puede causar la descarga de los cnidocitos sobre la cavidad bucal durante el proceso de ingestión del cnidario, muchos eólidos presentan una cutícula quitinosa que la protege. Los cnidocitos, tanto los que se han descargado, los que están en formación o los que no se han descargado, pasan al estómago. En éste, al igual que en la piel, las células epiteliales poseen unas estructuras ovoides intracelulares denominadas “usos”, que están compuestas de quitina y que tienen como función minimizar los posibles daños que puedan producir las descargas. A pesar de ello, los daños causados en los epitelios por las descargas se reparan rápidamente. También se produce una secreción de mucosidad que, aparte de proteger contra las descargas, tiene cierto poder de inhibición de la mismas."
Durante el proceso de ingestión, los nematocistos que no se han “disparado” se separan de los cnidocitos y pasan a la glándula digestiva. Allí son conducidos a los ceratas a través de las diferentes ramas de la glándula, siendo almacenados en unas estructuras que se encuentran en el ápice denominadas cnidosacos, normalmente rodeados de musculatura.
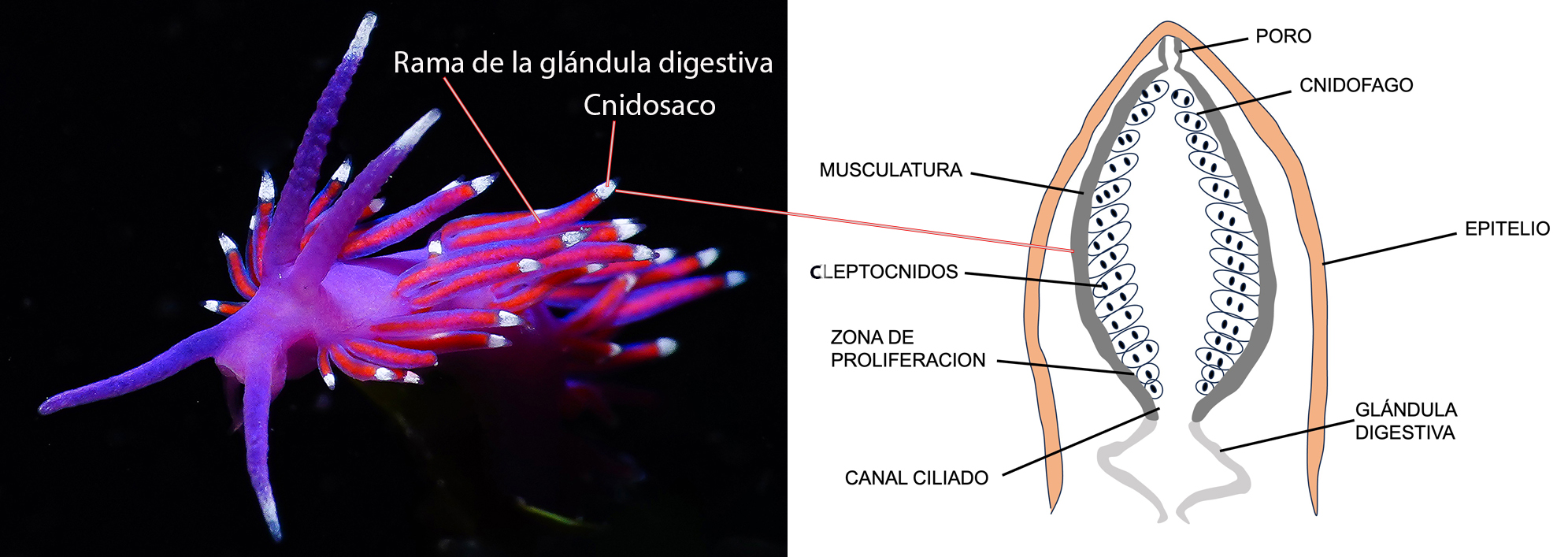
Estos nematocistos se incorporan al epitelio gracias a unas células que los fagocitan denominada “cnidofagos” formándose los “cleptocnidos”. En algunas especies los nematocistos en formación que son ingeridos terminan la misma en los cnidosacos.
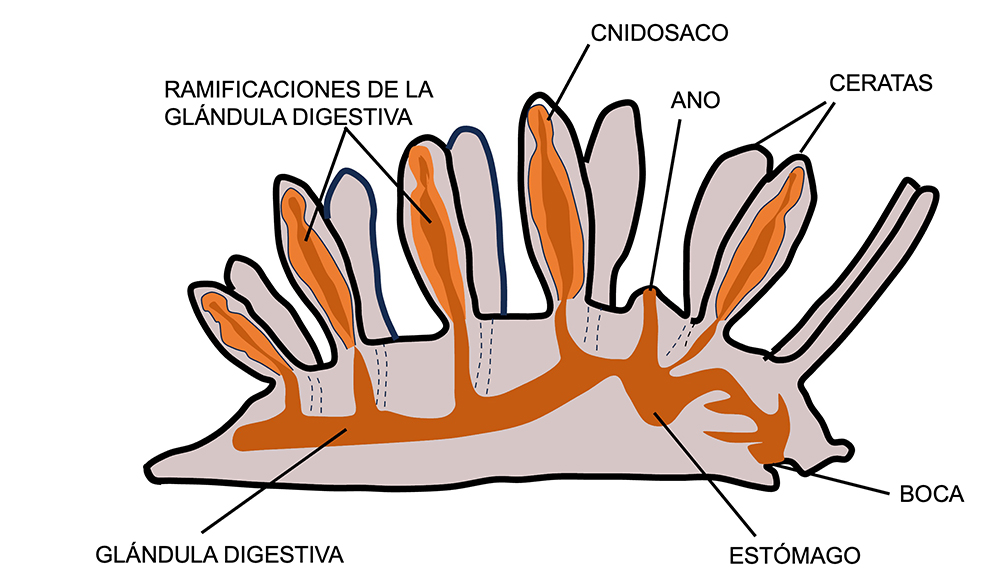
En caso de ataque de un depredador, se produce una contracción de la musculatura que rodea al cnidosaco, siendo expulsados los cleptocnidos al exterior a través de un pequeño poro que hay en el ápice de los ceratas, produciéndose la descarga de los nematocistos
El sistema de defensa anterior lo complementan algunas especies con la cripsis. En la imagen se aprecia la similitud entre un aeolídido (Facelina bostoniensis) y una anémona (Bunodeopsis strumosa), ambas sobre Zostera marina.
|
|
Las especies que no se alimentan de cnidarios, como Janolus cristatus, utilizan como defensa su parecido al resto de aeolídidos (mimetismo batesiano).

La capacidad de autotomizar partes de su cuerpo no sólo la tienen los aeolídidos, algunas especies de doridáceos también recurren a este método y, en caso de peligro, pueden fragmentar parcial o totalmente el borde del manto, que sirve de distracción al depredador mientras buscan refugio.
Un caso muy curiosos de autotomización es el que se da en la especie Elysia cf. marginata
Sayaka Mitoh And Yoichi Yusa 2021.Extreme autotomy and whole-body regeneration in photosynthetic sea slugs. Current Biology. vol31 DOI:https://doi.org/10.1016/j.cub.2021.01.014
A pesar de todo este arsenal defensivo, hay depredadores que los tienen en su dieta, como es el caso de estos pólipos coralinos.
 |
 |
MÁS INFORMACIÓN
VIDEOS
Viaje al interior del nudibranquio Polycera quadrilineata. Video del Prof. Javier Alba-Tercedor.
BIBLIOGRAFÍA
Litoral granadino
-Alba-Tercedor, J. & Sánchez-Tocino, L., 2011. The use of the SkyScan 1172 high-resolution micro-CT to elucidate if the spicules of the “sea slugs” (Mollusca: Nudibranchia, Opisthobranchia) have a structural or a defensive function. SkyScan Micro-CT User Meeting. pp. 113-121.
-Alba-Tercedor, J. & Sánchez-Tocino, L., 2012. High-resolution micro-CT of the Anatomy of the Sea Slug Polycera quadrilineata. Microscopy and Analysis. vol 26 (1) pp. 17-18.
-Sánchez-Tocino, L, Tierno de Figueroa, J.M. & Cervera, J.L. 2013. Ontogenetic changes in the spicule formation and their possible role in chromodorid opisthobranchs (Mollusca, Chromodorididae). Marine Biology Research. pp. 357-373.
General
- Avila, C., 1995. Natural products of opisthobranch molluscs: a biological review. Oceanography and Marine Biology Annual Review. 33: 487–559.
- Cheney, K.L.; Cortesi, F.; How, M.J.; Wilson, N.G.; Blomberg,S.P.; Winters, A.E.; Umanzör, S; & Marshall, N.J.Conspicuous visual signals do not coevolve with increased body size in marine sea slugs. Journal of evolutionary biology.
- Cimino, G., Fontana, A. & Gavagnin, M., 1999. Marine opisthobranch molluscs: chemistry and ecology in sacoglossans and dorids. Current Organic Chemistry 3: 327–372.
- Cimino, G. & Ghiselin, M.T., 2009. Chemical Defense and the Evolution of Opistobranch Gastropods. Proceedings of the California Academy of Sciences 60(10): 175–422.
- Cortesi, F. & Cheney, K.L.,2010. Conspicuousness is correlated with toxicity in marine opisthobranchs. Journal of Evolutionary Biology 23: 1509–1518.
- Faulkner, D.J. & Ghiselin, M.T.,1983. Chemical defense and evolutionary ecology of dorid nudibranchs and some other opisthobranch gastropods. Marine Ecology Progress Series 13: 295–301.
- García-Gómez, J.C., Cimino, G. & Medina, A., 1990. Studies on the defensive behavior of Hypselodoris species (Gastropoda: Nudibranchia) Ultrastructure and chemical analysis of mantle dermal formations (MDFs). Marine Biology 106: 245–250.
- García-Gómez, J.C., Medina, A. & Covenas, R., 1991 Study of the anatomy and histology of the mantle dermal formations (MDFs) of Chromodoris and Hypselodoris (Opisthobranchia: Chromodorididae). Malacologia 32(2): 41–46.
- Goodheart JA, Bely AE. 2017. Sequestration of nematocysts by divergent cnidarian predators: mechanism, function and evolution Invertebr Biol. 136:75–91.
Goodheart, J.A., Bleidißel, S., Schillo, D. et al. 2018. Comparative morphology and evolution of the cnidosac in Cladobranchia (Gastropoda: Heterobranchia: Nudibranchia). Front Zool15, 43. https://doi.org/10.1186/s12983-018-0289-2
- Gosliner, T.M.,2001. Aposematic coloration and mimicry in opisthobranch mollusks: new phylogenetic and experimental data. Bollettino Malacologico. 37: 163–170.
- Gosliner, T.M. & Behrens, D.,1990. Special resemblance, aposematic coloration and mimicry in opisthobranch gastropods. In: Wicksten M, editor. Symposium on the Adaptive Significance of Color in Invertebrates. Sponsored by the American Society of Zoologists. College Station: Texas A. & M. University Press. pp. 127–138.
- Greenwood PG., 2009. Acquisition and use of nematocysts by cnidarian predators. Toxicon. ;54:1065–70.
- Mollo, E., Gavagnin, M., Carbone, M., Guo, Y. & Cimino, G., 2005. Chemical studies on Indopacific Ceratosoma nudibranchs illuminate the protective role of their dorsal horn. Chemoecology 15: 31–36.
-Penney, B.K., 2006. Morphology and biological roles of spicule networks in Cadlina luteomarginata (Nudibranchia, Doridina). Invertebrate Biology, 125(3): pp. 222-232
-Ros, J., 1976. Sistemas de defensa en los opistobranquios. Oecologia Aquatica, 2: pp. 41-77.
-Ros, J.,1977. La defensa en los opistobranquios. Investigación y Ciencia, 12: pp. 48-60.
- Rudman, W.B., 1991. Purpose in pattern: the evolution of colour in chromodorid nudibranchs. Journal of Molluscan Studies. 57: 5–21.
- Thompson, T.E. 1990. Defensive adaptations in Opisthobranchs. J. Mar. Biol.Ass. U.K. 39: 123-134.
- Wägele, H. & Klussmann-Kolb, A.2005. Opisthobranchia (Mollusca, Gastropoda) - More than just slimy slugs. Shell reduction and its implications on defence and foraging.
PÁGINAS WEB
LUIS SÁNCHEZ TOCINO