Los opistobranquios son hermafroditas simultáneos. Su sistema reproductor realiza las siguientes funciones " producción de gametos, transferencia y maduración de gametos en varios órganos, cópula, fertilización y producción de la masa de huevos.” (Valdes et al. 2010). El sistema reproductor ascentral, según Ghiselin (1966) sería de tipo monáulico.
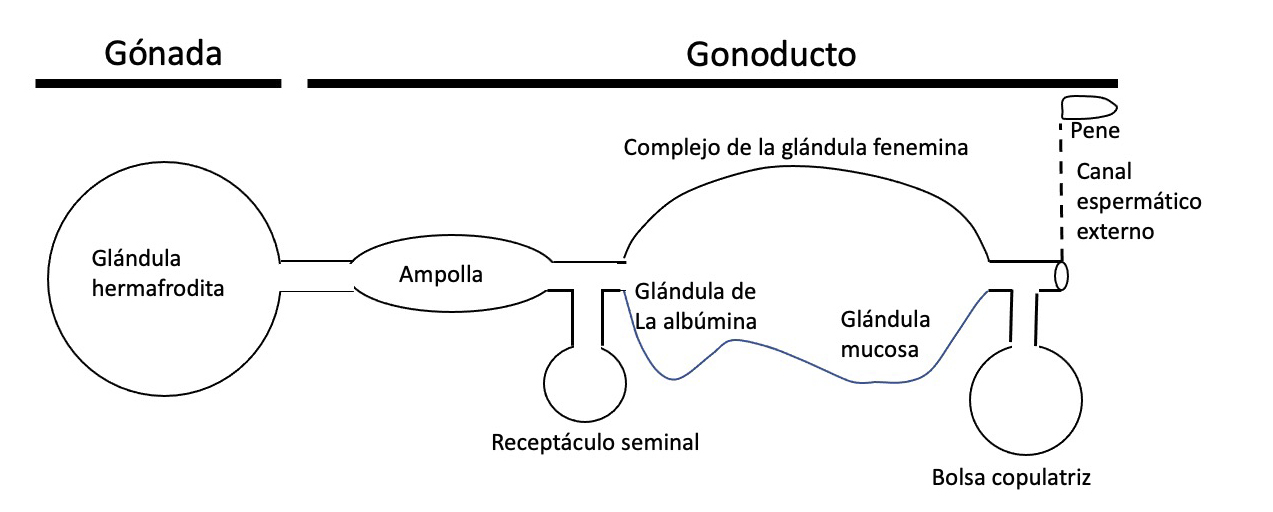
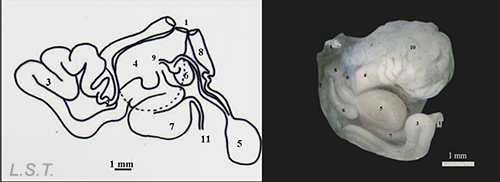
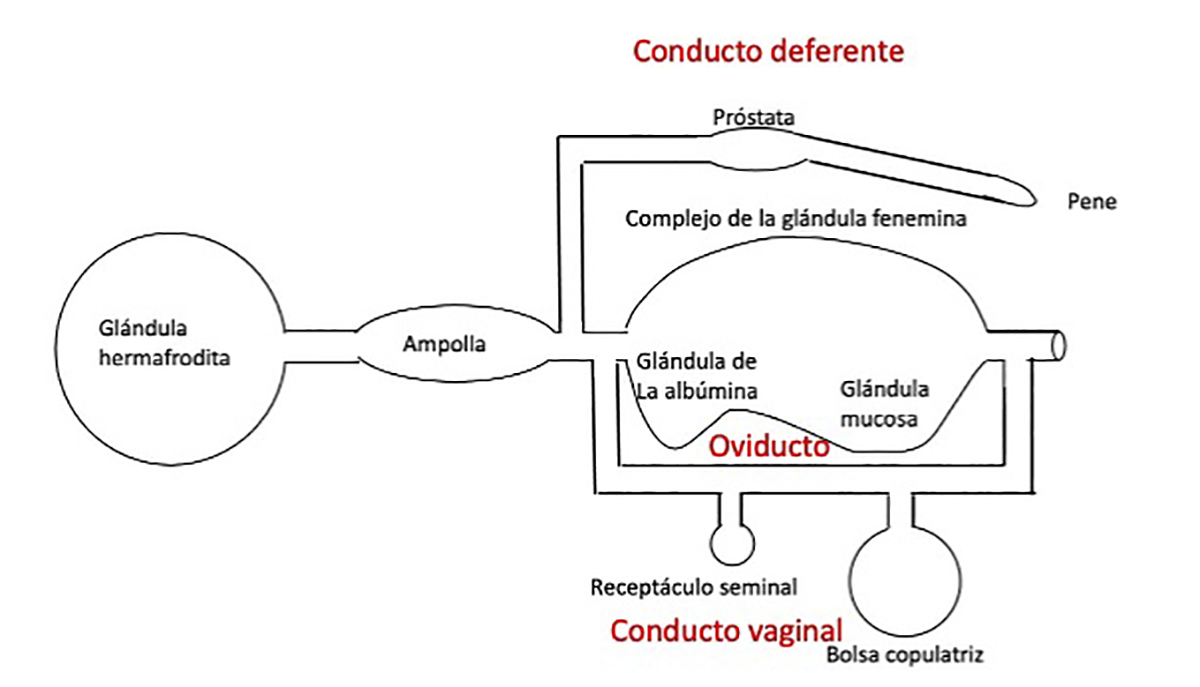
Aparte del sistema reproductor monáulico se reconocen otros dos tipos: diáulico y triáulico, este último es el representado en la figura anterior y en donde se pueden ver tres conductos separados (figura inferior): el conducto deferente (parte superior con la próstata y que finaliza en el pene), el oviducto (en el centro con la glándula femenina) y el conducto vaginal (inferior con la bolsa copulatriz y el receptáculo seminal)
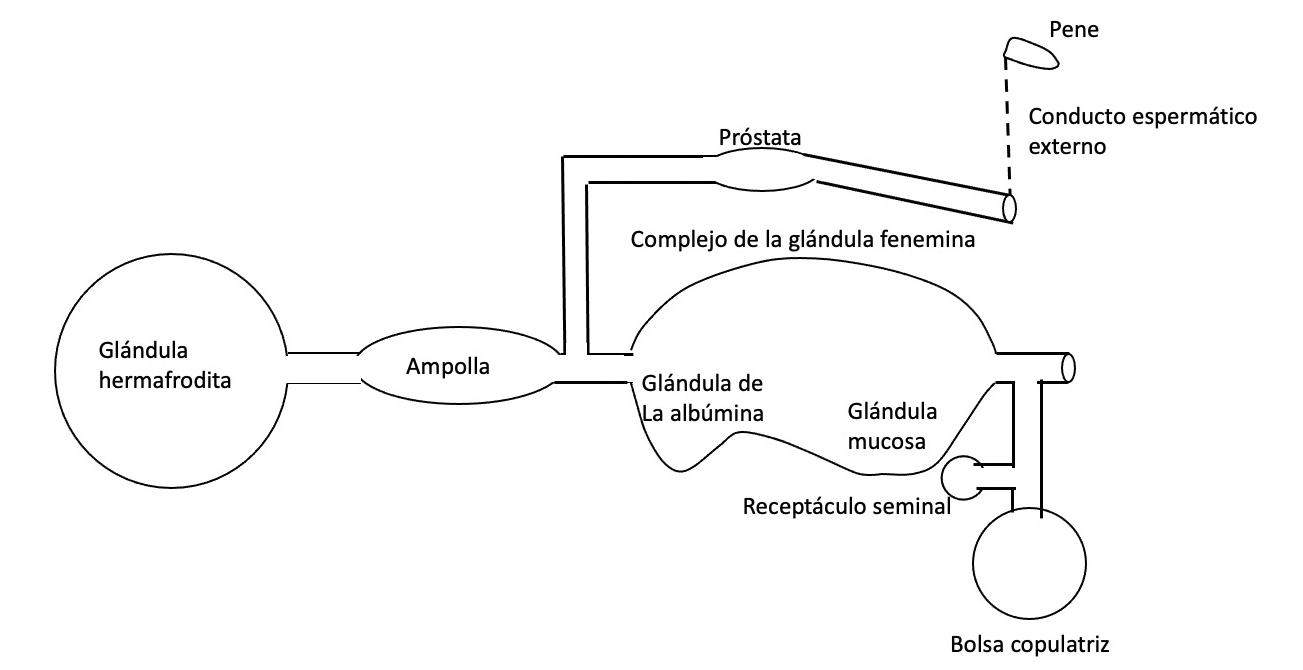
En el caso de aquellos que lo presentan diáulico puede ser a su vez de dos tipos (Ghiselin, 1966): androdiáulico en donde tenemos por un lado el conducto deferente y por otro el oviducto y conducto vaginal como un sólo conducto (por ejemplo Acteon)
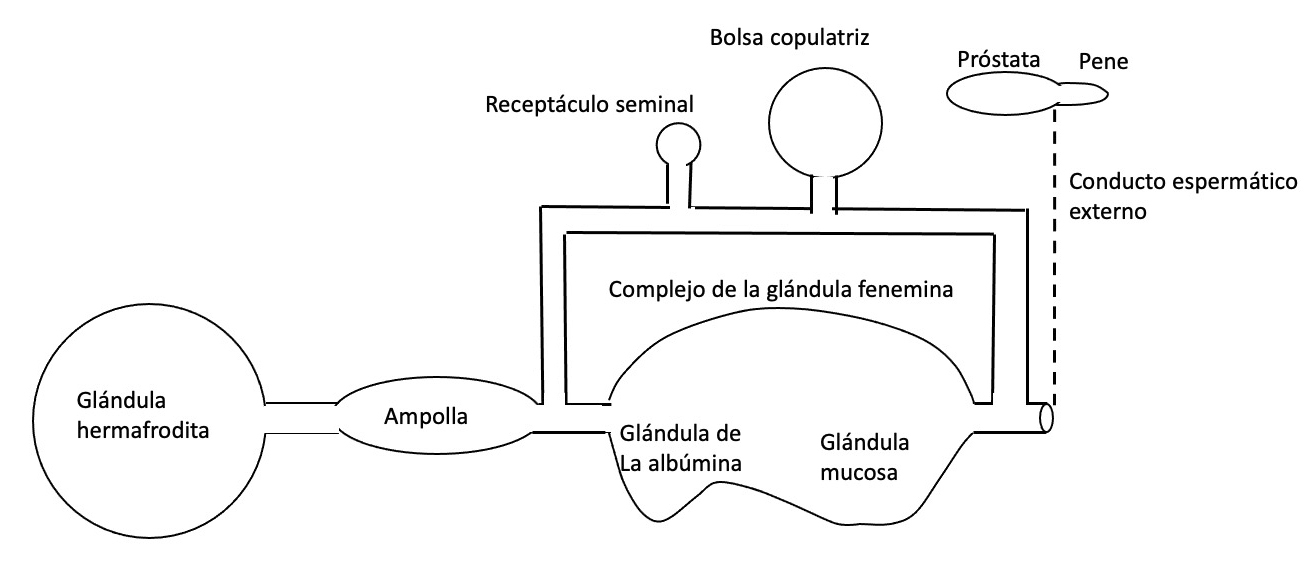
Y oodiáulico en donde presentan un oviducto separado (caso de Aplysia).
El atrio genital se encuentra, en general como es el caso de los nudibranquios, en la parte anterior derecha, por lo que los individuos se disponen para la cópula más o menos enfrentados y presentando ese lado.
Dos ejemplares de Trapania lineaba copulando sobre la esponja Sarcotragus spinosulus. En el de la izquierda se observa por transparencia un copépodo parásito y entre las branquias la puesta de éste. (Secuencia acelerada x3)
|
|
|
|
|
|
|
|
|
Las liebres de mar, con un sistema reproductor de tipo oodiáulico, son una de la excepciones a esta forma de copular, al disponer de un canal que conduce el esperma desde la parte dorsal, en donde se encuentra el atrio genital, hasta una especie de pene situado en la parte anterior derecha. El hecho de estar separados el pene y la vagina permite la cópula en cadena.
|
|
|
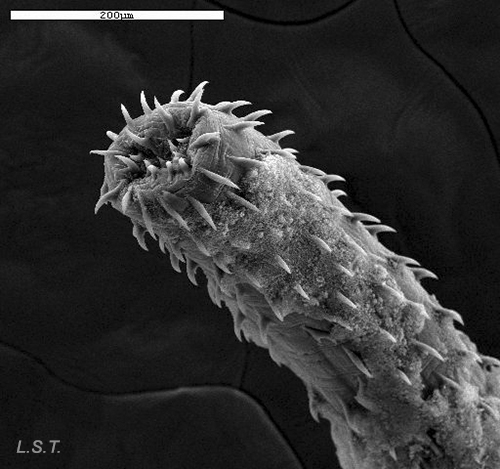
En algunas especies el pene puede estar armado con espinas, como el de la fotografía que pertenece a un doridáceo de las especie Tyrannodoris europaea, de esta forma encuentran en la vagina del otro ejemplar un punto de apoyo, para evitar que las turbulencias provocadas por el movimiento del agua, las separen durante la cópula.
|
|
|
El intercambio de esperma se realiza simultáneamente y éste se recoge en el denominado receptáculo seminal. En los siguientes videos se puede ver el paso del esperma durante la cópula de dos Polycera aurantiomarginata y dos Trapania lineata.
Ejemplares de Polycera aurantiomarginata copulando
Ejemplares de Trapania lineata copulando
El hermafroditismo simultáneos supone para las especies potencialmente caníbales, como es el caso de Tyrannodoris europaea, una mayor dificultad a la hora del apareamiento. En un estudio realizado por César Megina (2000), de diez encuentros realizados en el laboratorio sólo dos acabaron en cortejo, mientras que el desenlace de siete fue la lucha.
Encuentro de dos Tyrannodoris europea en el que se puede observar como el ejemplar de la parte superior saca el pene al exterior.
En el vídeo se puede ver el encuentro de dos ejemplares muy desiguales, en el que se observa el ataque del de mayor tamaño y que termina con la huida del pequeño
Antes de la ovoposición los huevos son fecundados y cubiertos por diferentes capas protectoras, para defenderlos de posibles depredadores.
|
|

|
Los huevos los depositan directamente sobre el sustrato, normalmente, formando espirales y no hay ningún tipo de cuidado parental.
|
|
|
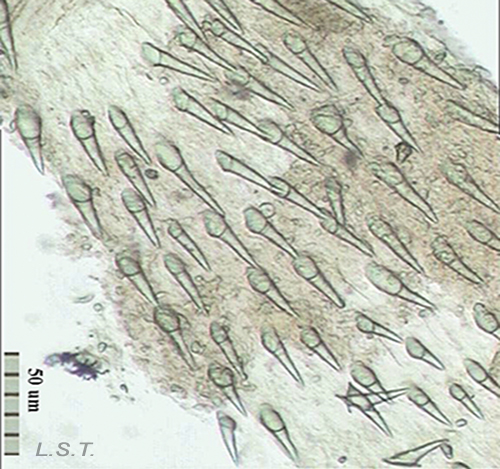
El tamaño de los huevos y el número de huevos por cápsula varía de unas especie a otras (Ver tabla). El color, tamaño y forma de la puesta varía entre especies.

|

|
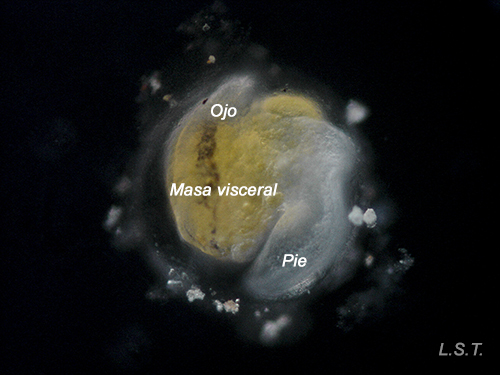
El número de huevos por puesta es variable e influye el tipo de desarrollo larvario. En las especies de tipo planctotrófico (que se alimentan de plancton), por ejemplo Trapania hispalensis, el número de huevos es muy elevado, de pequeño tamaño y con un menor tiempo entre la ovoposición y la eclosión. Las larvas velígeras, en este tipo de desarrollo, son casi transparentes al no tener prácticamente vitelo. Las que presentan un desarrollo de tipo lecitotrófico (se alimentan del vitelo), como Dendrodoris limbata, tienen un menor número de huevos y son de mayor tamaño. Las larvas son opacas debido al vitelo. Por último, en las especies con desarrollo directo, como Felimare villafranca, el número de huevos es muy reducido y la etapa velígera transcurre dentro del huevo.
Huevos de Dendrodoris limbata donde se pueden observar las larvas velígeras
|
|
|
|

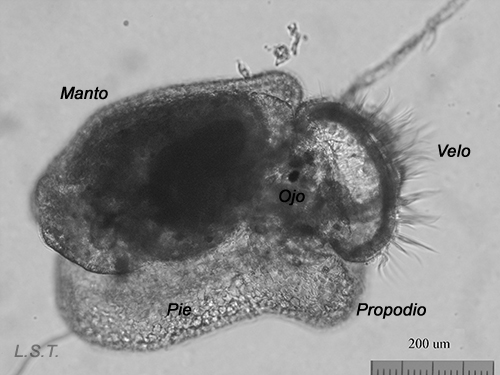
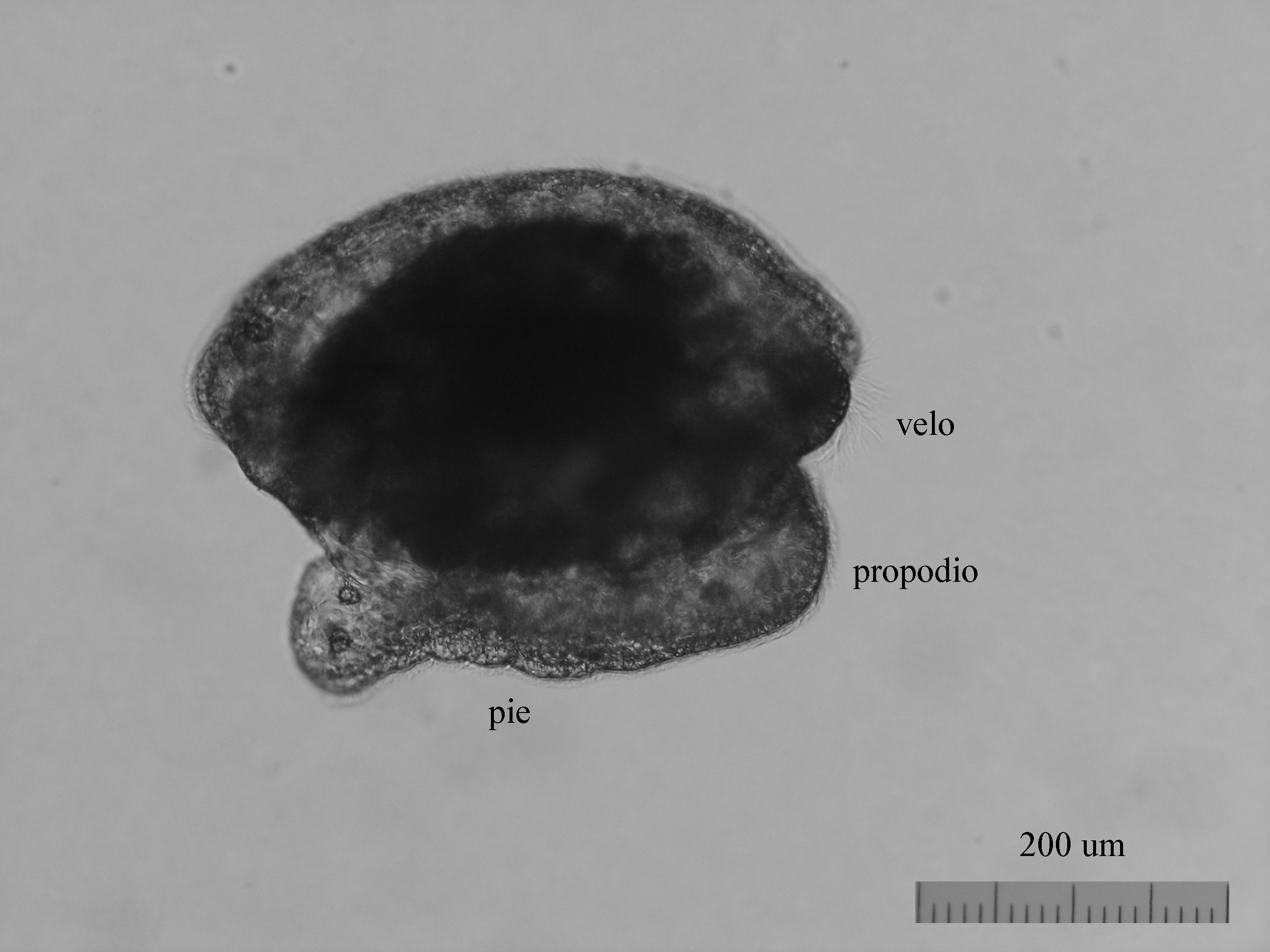
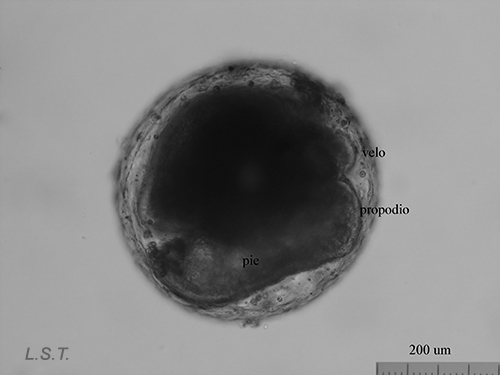
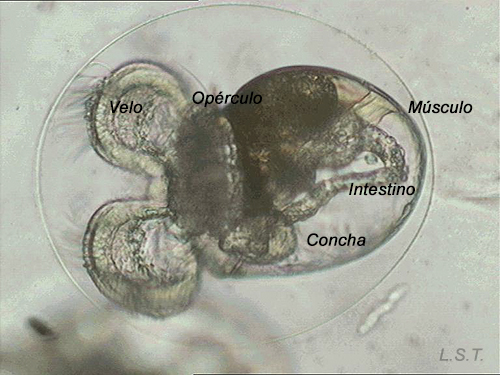
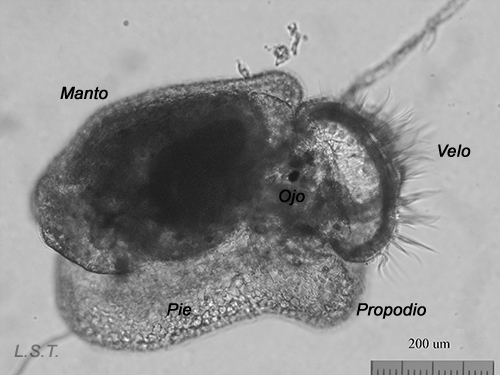
Del huevo, después de un periodo variable de unas especies a otras y que depende de factores como la temperatura ( a mayor temperatura menor tiempo), puede salir una larva nadadora denominada velígera, desarrollo planctotrófico o lecitotrófico, o un pequeño juvenil, desarrollo directo (Ver tabla). La larvas lecitotróficas presentan un velo más pequeño y pierden la concha rápidamente.
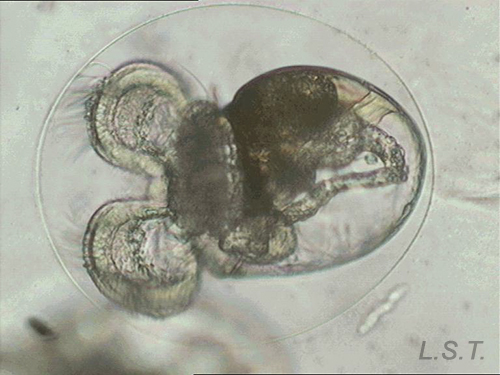
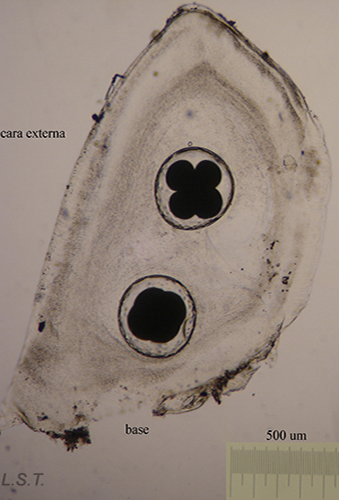
Velígera de F. bilineata (planctotrófica) rompiendo "la cáscara" del huevo.
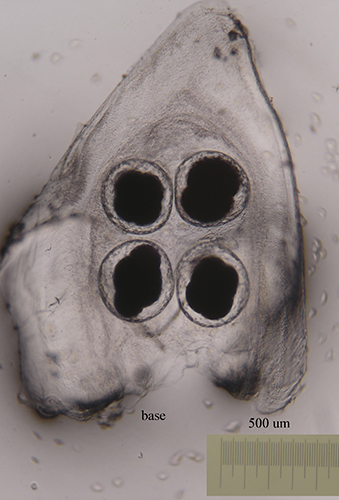
Larva velígera lecitotrótofica de Dendrodoris limbata.
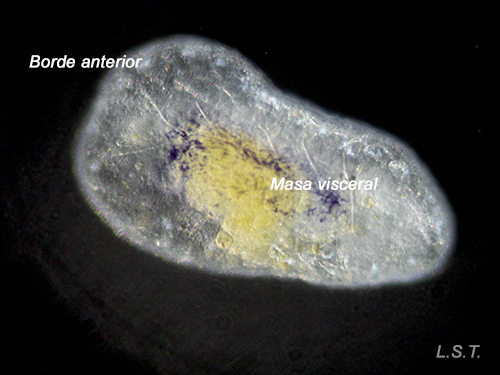
Felimare villafranca (desarrollo directo), justo antes, durante y después de abandonar el huevo.
El tipo de desarrollo, lógicamente, tiene una influencia directa en la distribución de las especies. Las de desarrollo planctotrófico pueden estar más tiempo en la columna de agua y, por tanto, recorrer grandes distancias empujadas por las corrientes, antes de que las larvas realicen la metamorfosis. Las especies lecitotróficas dependen del vitelo para su alimentación, por lo que éste limita su permanencia en el plancton, lo que disminuye su dispersión. El menor rango lo tienen las de desarrollo directo, al eclosionar directamente un juvenil de huevo.
 |
 |
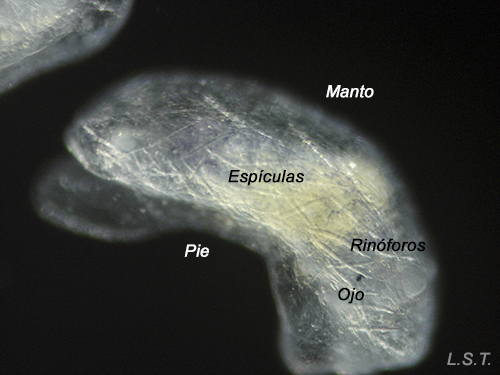
Juveniles con unos pocos días de Felimare villafranca. Se puede apreciar la incipiente coloración azul y el entramado de espículas defensivas del manto.
MÁS INFORMACIÓN
TABLA con las características de la puesta de algunos doridáceos de nuestro litoral.
| Especie | Nº de huevos por cápsula | Tamaño medio del huevo (µm) | Periodo embrionario en días | Tipo de desarrollo | Temperatura |
| F. fountandraui | 1 | 110 | 13 | 18º | |
| D. limbata | 1 | 222 | - | - | 18º |
| D. areolata | 1 | 80 | 12 | Planctotrófico | 18º |
| F. picta | 1-2 | 130 | + de 17 | 18º | |
| F. villafranca | 1 | 250 | - | Directo | 18º |
| F. purpurea | 1 | 93 | 13 | Planctotrófico | 18º |
| C. pellucida | 1 | 63 | 8 | Planctotrófico | 20º |
| F. bilineata | 1 | 65 | 11 | Planctotrófico | 20º |
| F. cantabrica | 1 | 85 | - | Planctotrófico | 22º |
| F. tricolor | 1 | 85 | 11 | Planctotrófico | 18º |
| Tayuva lilacina | 1 | 73 | 10 | Planctotrófico | 22º |
| D. rosi | 1 | 80 | 11 | Planctotrófico | 22º |
| A. banyulensis | 1 | - | - | Directo | - |
| J. onubensis | 1-2 | 63 | 9 | Planctotrófico | 22º |
| O. mediterranea | 1 | 77 | - | Planctotrófico | 22º |
| T. maculata | 1 | 100 | 11 | - | 22º |
| T. hispalenses | 1 | 83 | - | Planctotrófico | 22º |
| T. lineata | 1 | - | - | - | 22º |
| C. papillata | 1 | 72 | - | Planctotrófico | 22º |
| Paradoris indecora | 1 | 180 | - | - | 22º |
FOTOGRAFÍAS
|
|
|
|
|
|
|
|
|
BIBLIOGRAFÍA
Litoral granadino
-Sánchez-Tocino, L., Ocaña, A, García-García, F. y Cervera, J.L. 2007. Descripción de las puestas y desarrollo embrionario de algu- nos Doridoidea (Mollusca: Nudibranchia) del Sur de la Península Ibérica. Iberus, 25 (1): 1-20
General
- Ballesteros, M. y Ortea, J.A. 1980. Contribución al conocimiento de los Dendrodorididae (Moluscos: Opistobranquios: Doridáceos) del litoral ibérico. I, Publicaciones Departamento de Zoología, 5: 25-37.
- Bonar, D.B. 1978. Morphogenesis at metamorphosis in opisthobranch molluscs. Pp. 177-196, in F.-S. CHIA&M.E. RICE. Settlement and metamorphosis of marine invertebrate larvae. Elsevier/North-Holland Biomedical Press, New York.
-Megina, C. 2000. Dieta y especialización trofica en Moluscos Nudibranquios. Tesis Doctoral. Universidad de Cádiz. Inédita.157 pp.
-Megina, C. y Cervera, J.L. 2003. Diet, prey selection and cannibalism in the hunter opisthobranch Roboastra europaea. Journal Molluscan Biology Association U.K., 83, 4059/1-8.
- Coelho, R. & Calado, G., 2010. Spawn and early development of NE Atlantic species of Hypselodoris (Gastropoda: Opisthobranchia). Iberus 28(2): 63–72
- Domenech, A., Avila, C. y Ballesteros, M. 2002. Spatial and temporal variability of the opisthobranch molluscs of Port LLigat bay, Catalonia, NE Spain. Journal Molluscan Studies, 68: 29-37.
- Fernández- Ovies, C. L. 1979. Puestas, desarrollo y larvas de algunos opistobranquios. Tesis Doctoral, Universidad de Oviedo. 133 pp.
- Fernández- Ovies, C. L. 1981. Contribución a la clasificación morfológica de las puestas de los opistobranquios (Mollusca: Gastropoda). Boletín del Instituto de Estudios Asturianos, Ciencias Naturales, 28: 3-12
- Gantés, H. 1962. Recherches sur quelques larves de Glossodorididae (Mollusque, Opistobranches). Bulletin de la Société des Sciences Naturelles et Physiques du Maroc, 42 : 267-277.
- Ghiselin, M.T. 1966. Reproductive function an phylogeny of opisthobranch gastropods. Malacologia 3 (3): 327-378
- Miller, M.C. 1961. Annual cycles of some Manx nudibranchs, with a discusión of the problem of migration. Journal of Animal Ecology, 31: 545-569.
- Ros, J. 1981. Desarrollo y estrategias bionómicas en los Opistobranquios. Oecologia aquatica, 5: 147-183.
- Schmekel, L. & Portmann, A. 1982. Opisthobranchia des Mittelmeeres. Springer Verlag, Germany. 410 pp.
- Tchang-si, 1931. Un nouveau cas de condensation embryogényque chez un nudibranche (Doriopsis limbata Cuvier). Comptes Rendues de l´Academie dse Sciences de Paris. 192: 302-304.
- Thompson, T.E. 1967. “Direct development in a nudibranch, Cadlina laevis, with a discussion of developmental processes in Opisthobranchia”. Journal of Marine Biology, Ass U.K., 47: 1-22.
- Thompson, T.E. y Brown, G.H. 1984. Biology of Opisthobranch Molluscs. Vol. 2. Ray Society, London. 229 pp.
- Valdés, A. 1996. Revisión de la superfamilia Porodoridoidea Odhner en Franc 1968 (Mollusca: Nudibranchia) en el Océano Atlántico. Tesis Doctoral. Universidad de Oviedo. Inédita. 179 pp.
- Valdés, A.; Gosliner, T.M. & Ghiselin, M.T. 2010. Opisthobranch in The Evolution of Primary Characters in Animals. Edited by Leonard, J.L. and Cordoba-Aguilar, A. Oxford University Press.
- Wilson, N.G. 2002. Egg masses of chromodorid nudibranchs (Mollusca: Gastropoda: Opisthobranchia). Malacologia, 44(2): 289-305.
LUIS SÁNCHEZ TOCINO